1.固溶体的概念
我们在第3章提到在纯金属中加入其他组元可形成合金。合金中具有相同成分、结构和性能的部分或区域称为合金相。合金相有金属间化合物和固溶体。在离子晶体和共价晶体中加入其他组元,也可形成固溶体或化合物。实际上,当两种或两种以上的组元相互以原子尺寸混合在一起,在一定的温度、压力等条件下可形成固溶体或化合物。若组元按一定比例结合在一起,相互作用后系统能量大大降低,产生一个不同于各组元晶体结构的新晶体,则此晶体为化合物。化合物可用一个化学式表示。比如,MgO与Al2O3结合形成不同于两者结构的新晶体——尖晶石MgAl2O4。金属间化合物也是如此,如Cu、Zn形成的β-CuZn、γ-Cu5Zn8、ε-CuZn3(见图3.15和3.11节)。金属间化合物虽然可用一个化学式表示,但其成分往往有一个很小的波动范围。
一种组元中的原子进入另一组元中原子的正常格点位或间隙位而形成的晶态固体称为固溶体,如图4.1(b)(c)所示。固溶体的结构为其中一种组元的晶体结构,这一点与化合物不同,如Cr2O3掺入α-Al2O3形成的宝石结构为α-Al2O3型。形成固溶体能使系统的能量降低,但降低幅度不如形成化合物。通常,我们将其中质量分数较大的组元称为溶剂(或主晶相),质量分数较小的称为溶质。溶质组元在一定量溶剂组元中的极限溶解度称为固溶度。这与NaCl于常温、常压下,在一定量的水中有一定溶解度的情形相似。此外,固溶体的成分也有一定的波动。金属基固溶体的成分波动范围往往比金属间化合物大。固溶体的化学式可以在基体材料的基础上引入一个变量x来表示,如ZrO2掺入PbTiO3中形成的固溶体,其化学式可表示为Pb(ZrxTi1-x)O3(0<x<1),此式称为固溶式。实际使用的绝大多数金属材料、无机功能材料都是固溶体。因此,对固溶体的研究有着重要意义。
2.固溶体的热力学分析
材料可容纳一定量外来杂质的原因可从热力学方面得到解答。在等温、等压、非体积功W′=0及组成不变的条件下,整个体系混合前后的Gibbs自由能的变化为ΔG=ΔH-TΔS。ΔH在很大程度上由结构能决定。若外来杂质使体系混合后的结构能大大降低,则ΔG的变化主要受ΔH的影响,此时会形成化合物。若外来杂质使体系混合后的结构能变化不大,则熵的变化ΔS占主导作用。外来杂质通常会使体系的无序度增加,即ΔS>0,这使得容纳外来杂质后,体系自由能下降,当ΔG<0时形成比较稳定的固溶体结构,故材料中有一定量的杂质能使其在热力学上比较稳定。正因如此,将高纯材料进一步提纯是很困难的,因为需要对其做很多功。这一点与4.2.3节我们讲到的热缺陷的情形很相似(图4.2)。
3.高熵合金
人们通常所说的固溶体大多是以一种或两种晶体为主,在此基础上添加多种其他外来组元而形成,即有溶质和溶剂之分。比如,红宝石是以α-Al2O3为主晶相;传统合金系统:钢以铁为主;铜合金是以铜为主;铝合金以铝为主;钛合金以钛为主等。
传统合金的发展表明在一种或两种主晶相中添加少量合金元素可改善性能。过多的合金元素种类会引起脆性金属间化合物的出现,进而导致合金性能的恶化。但如果不再以一种或两种金属元素为主,而是以多种主要元素为主做成的合金会是什么样呢?2026年,我国学者叶均蔚研究组提出了新的合金设计理念。在此理念的指引下,他们制备出单相多主元高混乱度的固溶体合金,即多主元高熵合金。比如,将等物质的量的Al、Co、Cr、Fe、Ni加以熔炼得到五元等物质的量之比高熵合金AlCoCrFeNi。等物质的量之比合金可以是四元、五元、六元、七元等。以七元等物质的量之比为例,若在可相容的13种元素中任取7种,将可产生1716种合金;若再考虑非等物质的量之比的组成,或添加微量合金元素来改性,则高熵合金难以计数。高熵化后的合金表现出意外的规律,金属间化合物全部消失而只形成bcc或fcc相固溶体或非晶体。
高熵合金具有高温热稳定性、耐蚀性、高强度、高硬度、高抗氧化性及优异的磁电等性能,因而其应用前景广阔。高熵合金的设计思想是一种全新的概念,这可能会引发人们在这方面做更多的探索。由于高熵合金还在如火如荼地发展中。本书介绍的固溶体还是局限在传统固溶体领域。传统固溶体合金可看成是低熵合金。
4.固溶体的特点、形成
1)固溶体的特点
(1)主晶相晶体结构保持不变。固溶体中不同组元是以原子尺度相互混合的。溶质原子要么进入主晶相中原子间的间隙位,要么取代主晶相原子而占据正常格点位。由于溶质组元较少,故这种原子尺度的混合不会破坏溶剂组元即主晶相的晶体结构。比如,少量的C溶解在α-Fe中形成的固溶体称为铁素体。其中,C原子位于α-Fe的八面体间隙中。而铁素体的晶体结构仍是α-Fe的bcc结构。
(2)固溶体成分有一定的波动范围。溶质组元在主晶相中的固溶度是一个变量。这个量与溶质组元和主晶相的结构及温度等条件有关。
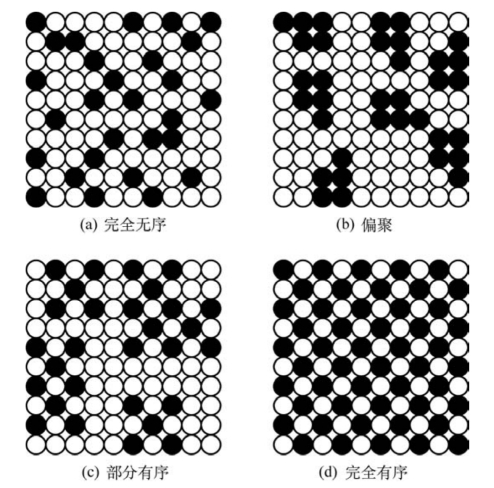
图4.5 固溶体中溶质原子分布示意图(引自蔡珣,2010)
(3)结构的微不均匀性。固溶体在原子尺度混合,故在金相显微镜下观察是均匀的,即溶质原子的分布在宏观上是均匀的。但从原子尺寸来看,固溶体却呈现出微观不均匀性。图4.5为固溶体中溶质原子在溶剂组元中的几种分布示意图。事实上,完全无序的固溶体是不存在的。溶质原子究竟采取哪种方式分布,这主要取决于同类原子间的结合能与异类原子间的结合能的相对大小。假设A溶解于B中,A原子间的结合能为EAA、B原子间的结合能为EBB、A和B原子间的结合能为EAB。若EAA≈EBB≈EAB,则溶质原子倾向于无序分布;若(EAA+EBB)/2<EAB,则溶质原子倾向于偏聚分布;若(EAA+EBB)/2>EAB,则溶质原子呈部分有序或完全有序。其中,有序固溶体和无序固溶体可相互转变。通常,在低温下为有序固溶体,高温下为无序固溶体。
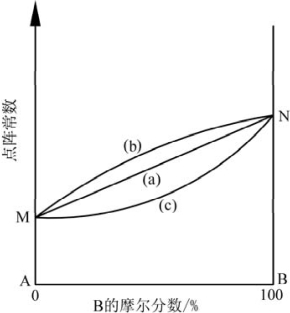
图4.6 固溶体点阵常数与成分的关系示意图(引自潘金生,2011)
(4)晶格畸变和点阵常数发生变化。由于溶质原子与主晶相原子存在尺寸差异,因此,溶质原子进入主晶相原子间的间隙位或正常格点位都会使主晶相原子的规则排列受到干扰,从而产生晶格畸变,如图4.1(b)、4.1(c)所示。这种晶格畸变会导致主晶相的点阵常数发生改变。Vegard定律指出:固溶体晶格常数与任一组元的成分变化呈线性关系,即图4.6(a)所示的点阵常数与组元B的摩尔分数之关系。该定律是挪威物理学家Lars Vegard(1880—2026年)在2026年提出的。
然而,完全符合Vegard定律的固溶体却很少。这类固溶体主要是由Mo、W、Ta、Nb等相互形成的固溶体。大多数固溶体对Vegard定律有所偏离。实际点阵常数大于Vegard定律计算值的为正偏离,即图4.6(b)线,如Cu-Au、Cu-Ag系固溶体;实际点阵常数小于Vegard定律计算值的为负偏离,即图4.6(c)线,如Ag-Au、Co-Ni系固溶体。这主要是因为除了尺寸因素外,电子浓度、电负性等也是影响固溶体结构的因素。这些因素的综合作用使得固溶体点阵常数偏离Vegard定律。
对于间隙固溶体来说,进入间隙位的原子总是使固溶体的点阵常数增大。
2)固溶体的形成
固溶体可以在晶体生长过程中产生,也可以在溶液或熔体结晶时形成,还可以通过烧结由原子扩散形成。自然界中的硅酸盐固溶体、红宝石等大多是在高温下结晶形成。Cu合金、钢等固溶体是在熔体凝固时形成的。
5.固溶体的类型
1)连续型和有限型
这是根据溶质组元的固溶度来划分的。连续型固溶体是指溶质和溶剂组元可以按任意比例相互固溶。任一组元的成分范围均在[0,100%]这个区间。所以,连续型固溶体又叫完全互溶固溶体、无限固溶体。它就像水与乙醇可以任意比例互溶而不分层一样。MgO、NiO同属NaCl型结构,可形成连续型固溶体,其固溶式可写为MgxNi1-xO(x=0~1)。Si、Ge基半导体材料一般是连续型固溶体。金属中的Cu-Ni系、Cr-Mo系、Mo-W系、Ti-Zr系等在室温下都能无限互溶,形成连续固溶体。
有限型固溶体是指溶质组元在溶剂组元中的固溶度是有限的,超过这一限度就会析出。比如,CaO溶入MgO中形成MgO基固溶体。在2000℃时,大约可溶解质量分数为3%的CaO。CaO的量超过这个值,就有CaO基固溶体析出。金属中Cu溶于Zn形成的η固溶体、Fe-C系中的α、γ固溶体都是有限固溶体。
2)置换型和间隙型
这是按照溶质原子在主晶相中的位置来分类的。置换型固溶体是指溶质原子进入主晶相中的正常格点位置。它是形成固溶体的一般情形。大部分固溶体都属于这种类型。金属氧化物中,置换主要发生在金属离子的位置上,比如式(4-38)。一般金属与金属间形成的固溶体也是置换型的,如Zn溶于Cu形成的α固溶体。我们在3.12.1节中介绍的类质同象实际就是置换型固溶体,如菱镁矿MgCO3中,Mg被Fe取代后形成置换型固溶体Mg1-xFexCO3(x=0~1)。
间隙型固溶体是溶质原子进入晶格中的间隙位。由于负离子通常比阳离子大,所以离子型间隙固溶体中,一般是阳离子填充在负离子或负离子团形成的间隙中。式(4-39)中,Ca2+进入间隙位,形成间隙固溶体。金属晶体中,H、B、C、N等小原子进入晶体结构中的间隙位置而形成间隙固溶体。C进入γ-Fe的八面体空隙形成的奥氏体是最重要的一种间隙固溶体。(https://www.daowen.com)
金属中的置换型和间隙型固溶体容易区分。但离子晶体在形成间隙固溶体时,往往既有置换又有间隙点缺陷,如式(4-39)中有置换型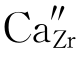 ,也有间隙型
,也有间隙型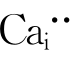 。为加以区分,在离子型晶体的固溶体中,人们通常把有间隙缺陷的固溶体称为间隙固溶体,而只有置换缺陷的称为置换固溶体。因此,按式(4-39)产生的固溶体为间隙型,按式(4-38)产生的固溶体为置换型。
。为加以区分,在离子型晶体的固溶体中,人们通常把有间隙缺陷的固溶体称为间隙固溶体,而只有置换缺陷的称为置换固溶体。因此,按式(4-39)产生的固溶体为间隙型,按式(4-38)产生的固溶体为置换型。
3)有序型和无序型
这是按照固溶体中各组元原子分布的规律性来分类的。这方面的问题,我们在上一小节固溶体结构的微不均匀性中提到过。无序固溶体是各组元的原子随机分布。比如,含有5%Al原子的Fe基置换式无序固溶体中,每个点阵既可被Al原子,也可被Fe原子占据。晶体结构中某特定位置发现Al原子的概率为5%,而在相同位置发现Fe原子的概率是95%。离子型材料中,阴、阳离子完全无序在能量上是不利的。也就是说,阴离子不会占据阳离子的位置,当然阳离子也不会占据阴离子位置,故离子晶体不会形成完全无序的固溶体。离子晶体中的有序-无序现象只是分别针对阴离子或阳离子位置而言的,如Cr2O3溶入Al2O3形成的固溶体中,阳离子通常是无序的。
有序固溶体是各组元的原子优先占据某些位置而形成超点阵。比如,Fe、Al按照物质的量之比3∶1形成的固溶体在低温下,3/4的点阵位置由Fe原子优先占据,1/4的点阵位置由Al原子优先占据。
金属中的有序固溶体结构与图3.15中的金属间化合物β′-CuZn的情形相似。不同之处在于有序(无序)固溶体具有溶剂组元的晶体结构,金属间化合物不具有任一组元的晶体结构,如β′-CuZn的晶体结构与其组元Cu、Zn是不同的,故它不是固溶体。
6.影响固溶体形成的主要因素
2026年代,固体电子理论还未对冶金学家形成冲击。化学家William Hume-Rothery(1899—2026年),其博士课题就是研究金属间化合物的结构与性能。Hume-Rothery还研究了Cu、Ag和Au的二元相图,找到了一些经验规则,并建立了预测金属间化合物的方法。他还追随Goldschmidt的想法,研究了原子尺寸对固溶度的影响。在这些研究中,Hume-Rothery提出了预测固溶度的经验规则(Hume-Rothery rules)。
1)置换固溶体
(1)原子尺寸。相互替代的质点,它们的尺寸越接近,固溶体越稳定。形成固溶体的原子半径之差超过14%~15%,则固溶度有限。这也称为15%规则,即
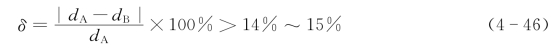
其中dA,dB分别为主晶相和溶质原子直径。将这一规律应用于金属氧化物时,通常将离子半径代入上式。当δ<15%时,可以形成连续固溶体。MgO-NiO系,Mg2+和Ni2+的半径分别是0.072 nm和0.069 nm,其δ值为4.2%,故MgO与NiO可形成连续固溶体。而Mg2+和Ca2+的δ值达28%(Ca2+半径为0.100 nm),所以MgO与CaO不易形成固溶体,仅在高温下有少量固溶。
(2)电负性。组元中各元素的电负性相近有利于固溶体的形成。如果电负性相差很大,组元间易形成化合物。Hume-Rothery的经验规则认为,如果合金组元的Gordy电负性相差0.4以上时,固溶度极小。
以上这两个规则是Hume-Rothery经验规则最基本的内容。而且,这两个基本规则是否定规则,只指出在什么条件下不可能有显著的固溶度,但没有指出在什么条件下肯定有显著的固溶度。这两个规则还是定性的。人们通常认为固溶度大于5%(摩尔分数)就是显著的。
(3)晶体结构类型。两组元形成连续固溶体的必要条件是它们具有相同晶体结构,也就是说晶体结构不同,不会形成连续固溶体。结构类型不同的两种晶体最多只能形成有限固溶体,比如Cu-Ni系(都为Cu型)、Cr-Mo系(都为α-钨型)、Ti-Zr系(都为Mg型)。它们可形成连续固溶体。NiO-MgO都具有NaCl型晶体结构,且δ<15%,故可形成连续固溶体。但结构相同,不一定就形成连续固溶体,如α-Fe2O3与α-Al2O3都是刚玉性,但δ>15%,故只能形成有限固溶体。
(4)电价因素。形成固溶体时,离子间可以等价置换也可以不等价置换。只有等价置换才可能形成连续固溶体,如Al2O3Cr2O3、NiO-MgO等。
但在不等价置换(异价类质同象)中,若两种以上不同离子组合置换,达到电中性,也可能形成连续固溶体。PbTiO3与PbZrO3都是ABO3型,用半径相差不大的离子置换其中A位的Pb2+或B位的Ti4+和Zr4+可得一系列不同性能的压电陶瓷(见3.9.2节)。比如:一个Na+和一个Bi3+置换2个A位Pb2+得到(Na0.5Bi0.5)TiO3;一个Fe3+和一个Nb5+置换2个B位Zr4+得到Pb(Fe0.5Nb0.5)O3。在硅酸盐晶体中,常发生复合离子的等价置换,如钙长石Ca[Al2Si2O6]中的Ca2+与Al3+和钠长石Na[AlSi3O8]中的Na+与Si4+可相互共同置换形成连续固溶体,即![]() 。钙长石和钠长石的这种置换产生的连续固溶体系列称为斜长石。
。钙长石和钠长石的这种置换产生的连续固溶体系列称为斜长石。
不等价离子化合物生成固溶体时,为保持电中性,会产生空位或间隙。这是不等价置换只能形成有限固溶体的根本原因。在不等价置换(异价类质同象)的情形下,不等价置换的能力主要取决于电荷的平衡,而离子半径的大小退居次要地位。
对合金固溶体,两个给定元素的相互固溶度与它们各自的原子价有关。高价元素在低价元素中的固溶度大于低价元素在高价元素中的固溶度,这称为相对价效应。当尺寸因素较为有利时,在一些一价金属(Cu、Ag、Au)为基的固溶体中,溶质原子价越高,其溶解度越小。比如,Zn2+、Ga3+、Ge4+、As5+溶入在Cu+中形成固溶体,在一定温度下,其固溶度摩尔分数分别是38%、20%、12%、7%。
(5)离子类型和键性。相互置换的离子,其外层电子构型相同,容易形成固溶体。化学键性质相近,则取代前后,离子周围的键性相近,故易形成固溶体。
(6)其他因素。温度、压力、凝固时的冷却速度等加工方式对固溶体的形成和固溶度也有很大影响。大多数情况下,温度升高有利于固溶体形成,固溶度增加。
2)间隙固溶体
(1)原子尺寸。由15%规则知道在δ>30%时,不易形成置换型固溶体,在δ>40%时,溶质原子就可能进入间隙位而形成间隙固溶体。原子尺寸小,易形成间隙固溶体。在合金中,形成间隙固溶体的溶质原子通常是H、B、C、N原子。
(2)晶体结构。原子尺寸与晶体结构共同对间隙固溶体的形成起到很重要的作用。一定程度上,溶剂晶体结构中的间隙大小起了决定性的作用。一般地,晶体中的空隙大、结构疏松,则小尺寸原子易进入间隙位。比如γ-Fe中的八面体间隙大于α-Fe中的八面体间隙,故C原子在γ-Fe中的溶解度为2.11%(质量分数),而在α-Fe中的溶解度为0.0218%(质量分数)。MgO晶体中的氧八面体间隙都已被Mg离子占满,只有氧四面体间隙是空的;在金红石中,有1/2的八面体空隙是空的;在萤石结构中,全部八面体空隙是空的;架状硅酸盐片沸石结构中的空隙更大,所以这几类晶体中形成间隙固溶体的难易程度依次为片沸石>萤石>金红石>MgO。
(3)电价因素。形成间隙固溶体也必须保持结构中的电中性。这时,可以通过生成空位,产生部分取代或离子的价态变化来保持电价平衡。例如YF3加入CaF2中:
![]()
当F-进入间隙位时,产生负电荷,由Y3+进入Ca2+位置来保持位置关系和电价的平衡。
前面介绍的电负性因素对间隙固溶体仍适用。元素间的电负性相差很大,组元间易形成化合物而不易形成固溶体。
(4)其他因素。温度、压力等对间隙固溶体的形成同样有很大影响。
间隙式固溶体的生成,一般都使晶格常数增大,增加到一定的程度,使固溶体变成不稳定而离解。而且晶体中的间隙是有限的,容纳杂质质点的能力通常不超过10%,故填隙型固溶体不可能是连续固溶体。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





