与化学反应式一样,缺陷反应式也需要一些规则,这些规则有以下四种。
1.位置关系
晶体中原子的位置数比例要保持不变。这主要是因少量的缺陷并未改变主晶相的结构,比如化合物MaXb,M与X的位置数之比始终是a∶b。
需注意:这里指的是位置数的比例不变,而不是原子数或它们的位置数量不变。TiO2中Ti、O位置数之比为1∶2。当它在还原性气氛中时,氧会逸出晶格,化学式变为TiO2-x,其原子数之为1∶(2-x),但Ti、O位置数之比仍是1∶2。我们也可这样理解:晶体中的每个格点始终属于无缺陷时原来原子的位置,不会因为产生了缺陷,那个位置就属于别的原子了。比如在MgO中引入少量Al2O3,Al3+置换Mg2+产生缺陷![]() ,这个缺陷的位置还是Mg2+的位置,而不是Al3+的位置。
,这个缺陷的位置还是Mg2+的位置,而不是Al3+的位置。
2.位置增殖
缺陷的产生可能会引起空位数的变化,而位置数之比又要保持不变。故有引起位置数增加的缺陷:MM、MX、XX、XM、VX、VM对位置数目的增加有贡献;而Mi、Xi、e′、h·不在正常格点位置上,对位置数无影响。
质点移动到表面(如肖特基缺陷),位置数增加;质点从表面移动到内部格点上,表面位置消失,因此位置数减少。当一个原子M从晶体内部迁移到表面时常用符号Ms表示。
3.质量平衡
需注意:这里指的是位置数的比例不变,而不是原子数或它们的位置数量不变。TiO2中Ti、O位置数之比为1∶2。当它在还原性气氛中时,氧会逸出晶格,化学式变为TiO2-x,其原子数之为1∶(2-x),但Ti、O位置数之比仍是1∶2。我们也可这样理解:晶体中的每个格点始终属于无缺陷时原来原子的位置,不会因为产生了缺陷,那个位置就属于别的原子了。比如在MgO中引入少量Al2O3,Al3+置换Mg2+产生缺陷![]() ,这个缺陷的位置还是Mg2+的位置,而不是Al3+的位置。
,这个缺陷的位置还是Mg2+的位置,而不是Al3+的位置。
2.位置增殖
缺陷的产生可能会引起空位数的变化,而位置数之比又要保持不变。故有引起位置数增加的缺陷:MM、MX、XX、XM、VX、VM对位置数目的增加有贡献;而Mi、Xi、e′、h·不在正常格点位置上,对位置数无影响。
质点移动到表面(如肖特基缺陷),位置数增加;质点从表面移动到内部格点上,表面位置消失,因此位置数减少。当一个原子M从晶体内部迁移到表面时常用符号Ms表示。
3.质量平衡
与化学反应方程一样,方程两边质量要保持平衡。在配平方程时要注意缺陷符号的下标表示的是谁的位置,不代表质量。比如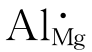 ,在配平时,只考虑Al的质量和数量,不考虑Mg。空位对质量平衡也无意义,不予考虑。
,在配平时,只考虑Al的质量和数量,不考虑Mg。空位对质量平衡也无意义,不予考虑。
4.电荷守恒
晶体必须保持电中性。反应方程两边的有效电荷数要相等。
5.本征热缺陷方程
(1)弗仑克尔缺陷
以AgBr为例,Ag+半径小,进入间隙位有
与化学反应方程一样,方程两边质量要保持平衡。在配平方程时要注意缺陷符号的下标表示的是谁的位置,不代表质量。比如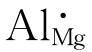 ,在配平时,只考虑Al的质量和数量,不考虑Mg。空位对质量平衡也无意义,不予考虑。
,在配平时,只考虑Al的质量和数量,不考虑Mg。空位对质量平衡也无意义,不予考虑。
4.电荷守恒
晶体必须保持电中性。反应方程两边的有效电荷数要相等。
5.本征热缺陷方程
(1)弗仑克尔缺陷
以AgBr为例,Ag+半径小,进入间隙位有
其中nil表示无缺陷。
利用化学课中学的质量作用定律(the law of mass action)也可得出缺陷的平衡摩尔分数。质量作用定律表明当化学反应在一定温度和压力下达成平衡时,生成物和反应物各组元摩尔分数的乘积之比为一常数,即平衡常数K。由式(4-31)得
其中nil表示无缺陷。
利用化学课中学的质量作用定律(the law of mass action)也可得出缺陷的平衡摩尔分数。质量作用定律表明当化学反应在一定温度和压力下达成平衡时,生成物和反应物各组元摩尔分数的乘积之比为一常数,即平衡常数K。由式(4-31)得
其中![]() 分别为
分别为![]() 的平衡摩尔分数,
的平衡摩尔分数,![]() 为常数。而
为常数。而![]() ,设hF为缺陷形成能,则
,设hF为缺陷形成能,则
其中![]() 分别为
分别为![]() 的平衡摩尔分数,
的平衡摩尔分数,![]() 为常数。而
为常数。而![]() ,设hF为缺陷形成能,则
,设hF为缺陷形成能,则
其中K0=![]() 。式(4-33)与式(4-17)是一致的,K0相当于式(4-17)中的
。式(4-33)与式(4-17)是一致的,K0相当于式(4-17)中的![]() 。
。
(2)肖特基缺陷
以MgO为例,Mg2+,O2-迁移到表面,在内部留下空位,则
其中K0=![]() 。式(4-33)与式(4-17)是一致的,K0相当于式(4-17)中的
。式(4-33)与式(4-17)是一致的,K0相当于式(4-17)中的![]() 。
。
(2)肖特基缺陷
以MgO为例,Mg2+,O2-迁移到表面,在内部留下空位,则
同样,缺陷的平衡摩尔分数有以下关系:
同样,缺陷的平衡摩尔分数有以下关系:(www.daowen.com)
设hS为缺陷形成能,有
设hS为缺陷形成能,有
这也和式(4-24)一致。除了热缺陷外,晶体中还有掺杂产生的缺陷。
6.掺杂缺陷反应式
掺杂缺陷反应式的基本形式可表示为
这也和式(4-24)一致。除了热缺陷外,晶体中还有掺杂产生的缺陷。
6.掺杂缺陷反应式
掺杂缺陷反应式的基本形式可表示为
缺陷反应式在掺杂、固溶体中有重要应用,下面举例对此说明。杂质进入基体时,杂质的正、负离子分别占据基体正、负离子的位置,这样产生的畸变小。
缺陷反应式在掺杂、固溶体中有重要应用,下面举例对此说明。杂质进入基体时,杂质的正、负离子分别占据基体正、负离子的位置,这样产生的畸变小。
在上一章萤石结构部分,我们提到ZrO2的单斜相与四方相在转变过程中,有约9%的体积变化,而难以获得稳定的ZrO2陶瓷。如果在ZrO2中引入少量CaO、Y2O3则可以获得稳定Zr O2。它们的缺陷反应式有多种写法。第一种写法,我们先满足基体ZrO2中阳离子的位置数:Zr与O的位置数之比为1∶2,即先满足1。每引入一个CaO,就有一个Ca2+、O2-进入基体中。Ca2+占据Zr4+位置,产生一个Zr4+位置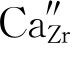 ,引入的O2-占据氧的位置OO。由于ZrO2中Zr与O的位置数之比为1∶2,故还需要一个氧的位置。根据前述位置增殖,我们可知:氧的空位可以提供一个位置
,引入的O2-占据氧的位置OO。由于ZrO2中Zr与O的位置数之比为1∶2,故还需要一个氧的位置。根据前述位置增殖,我们可知:氧的空位可以提供一个位置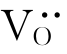 ,因此其缺陷反应式如下:
,因此其缺陷反应式如下:
在上一章萤石结构部分,我们提到ZrO2的单斜相与四方相在转变过程中,有约9%的体积变化,而难以获得稳定的ZrO2陶瓷。如果在ZrO2中引入少量CaO、Y2O3则可以获得稳定Zr O2。它们的缺陷反应式有多种写法。第一种写法,我们先满足基体ZrO2中阳离子的位置数:Zr与O的位置数之比为1∶2,即先满足1。每引入一个CaO,就有一个Ca2+、O2-进入基体中。Ca2+占据Zr4+位置,产生一个Zr4+位置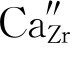 ,引入的O2-占据氧的位置OO。由于ZrO2中Zr与O的位置数之比为1∶2,故还需要一个氧的位置。根据前述位置增殖,我们可知:氧的空位可以提供一个位置
,引入的O2-占据氧的位置OO。由于ZrO2中Zr与O的位置数之比为1∶2,故还需要一个氧的位置。根据前述位置增殖,我们可知:氧的空位可以提供一个位置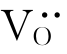 ,因此其缺陷反应式如下:
,因此其缺陷反应式如下:
位置数之比符合1∶2,电荷和质量也守恒。
位置数之比符合1∶2,电荷和质量也守恒。
第二种写法,我们先满足基体ZrO2中阴离子的位置数,即1∶2中的2。每引入一个CaO只能引入一个O2-,所以需引入2个CaO,产生两个氧位置OO。两个氧位置只需一个Zr4+位置,这由Ca2+占据Zr4+位置来提供,结果产生缺陷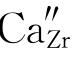 。剩下的一个Ca不产生位置,只有进入间隙位
。剩下的一个Ca不产生位置,只有进入间隙位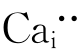 。其缺陷反应式如下:
。其缺陷反应式如下:
第二种写法,我们先满足基体ZrO2中阴离子的位置数,即1∶2中的2。每引入一个CaO只能引入一个O2-,所以需引入2个CaO,产生两个氧位置OO。两个氧位置只需一个Zr4+位置,这由Ca2+占据Zr4+位置来提供,结果产生缺陷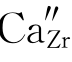 。剩下的一个Ca不产生位置,只有进入间隙位
。剩下的一个Ca不产生位置,只有进入间隙位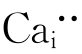 。其缺陷反应式如下:
。其缺陷反应式如下:
位置数之比符合1∶2,电荷和质量也守恒。
这两种写法比较常见。实际上,我们还可以有其他写法。只要符合我们在前面介绍的规则,写出的缺陷反应式都是可行的。至于其中哪种写法符合实际,只有通过实验检测。但我们可通过第3章结构部分的相关知识做一个初步判断。结构紧密的晶体中,半径大的原子很难形成间隙缺陷。通常情况下,除了萤石结构可出现间隙阴离子外,其他结构很难出现间隙阴离子。这和热缺陷的形成相似,因间隙缺陷的形成能通常要大于空位形成能。把少量CaO引入ZrO2中的两种写法,实验结果表明式(4-38)的缺陷反应更常见。
再比如,把Y2O3引入ZrO2中的缺陷反应式为
位置数之比符合1∶2,电荷和质量也守恒。
这两种写法比较常见。实际上,我们还可以有其他写法。只要符合我们在前面介绍的规则,写出的缺陷反应式都是可行的。至于其中哪种写法符合实际,只有通过实验检测。但我们可通过第3章结构部分的相关知识做一个初步判断。结构紧密的晶体中,半径大的原子很难形成间隙缺陷。通常情况下,除了萤石结构可出现间隙阴离子外,其他结构很难出现间隙阴离子。这和热缺陷的形成相似,因间隙缺陷的形成能通常要大于空位形成能。把少量CaO引入ZrO2中的两种写法,实验结果表明式(4-38)的缺陷反应更常见。
再比如,把Y2O3引入ZrO2中的缺陷反应式为
式(4-38)和式(4-40)表明引入少量CaO、Y2O3后,在ZrO2中有氧空位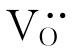 产生。
产生。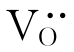 使O2-在高温下容易移动。所以这种稳定型的ZrO2常作氧敏感元件来检测冶炼金属中的氧浓度、控制汽车燃料燃烧时的空气和燃料的比例。掺杂ZrO2还是固体氧化物燃料电池的电解质材料。
使O2-在高温下容易移动。所以这种稳定型的ZrO2常作氧敏感元件来检测冶炼金属中的氧浓度、控制汽车燃料燃烧时的空气和燃料的比例。掺杂ZrO2还是固体氧化物燃料电池的电解质材料。
式(4-38)和式(4-40)表明引入少量CaO、Y2O3后,在ZrO2中有氧空位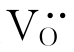 产生。
产生。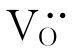 使O2-在高温下容易移动。所以这种稳定型的ZrO2常作氧敏感元件来检测冶炼金属中的氧浓度、控制汽车燃料燃烧时的空气和燃料的比例。掺杂ZrO2还是固体氧化物燃料电池的电解质材料。
使O2-在高温下容易移动。所以这种稳定型的ZrO2常作氧敏感元件来检测冶炼金属中的氧浓度、控制汽车燃料燃烧时的空气和燃料的比例。掺杂ZrO2还是固体氧化物燃料电池的电解质材料。
德国科学家Carl Wagner(1901—1977年)首先研究了这种稳定ZrO2。他在1943年首先认识到ZrO2是离子导电而不是电子导电,即ZrO2主要通过空位的运动而导电,它是一种有离子导电性质的固体。但纯ZrO2仅靠温度引起的热缺陷,特别是氧空位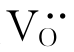 少,因此不能用作测量元件。
少,因此不能用作测量元件。
采用两种及两种以上电价不同的化合物,掺杂形成固溶体是获得离子半导体的一种有效方法。有关离子电导,请读者结合材料物理性能课程,或参阅清华大学出版社的《无机材料物理性能》来学习。下面我们列举一些缺陷反应,供读者参考。
TiO2掺杂Nb2O5:
德国科学家Carl Wagner(1901—1977年)首先研究了这种稳定ZrO2。他在1943年首先认识到ZrO2是离子导电而不是电子导电,即ZrO2主要通过空位的运动而导电,它是一种有离子导电性质的固体。但纯ZrO2仅靠温度引起的热缺陷,特别是氧空位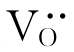 少,因此不能用作测量元件。
少,因此不能用作测量元件。
采用两种及两种以上电价不同的化合物,掺杂形成固溶体是获得离子半导体的一种有效方法。有关离子电导,请读者结合材料物理性能课程,或参阅清华大学出版社的《无机材料物理性能》来学习。下面我们列举一些缺陷反应,供读者参考。
TiO2掺杂Nb2O5:
Nb2O5掺杂TiO2:
Nb2O5掺杂TiO2:
Cr2O3掺杂Al2O3:
Cr2O3掺杂Al2O3:
由于Cr、Al化合价相同,故没有产生带电缺陷。纯刚玉中的所有电子皆已配对,对白光无吸收,所以呈无色。但引入Cr3+后,有未配对电子。当可见光照射红宝石时,对短波长的光有吸收而呈红色,这就是红宝石颜色的来源。
在掺入外来原子时,杂质原子分别进入基体的相应位置。这与在水里溶解盐,形成溶液的情形相似。而且整个体系最后是以固体的形式存在,故我们把它称作固体溶液,简称固溶体(solid solution)。
由于Cr、Al化合价相同,故没有产生带电缺陷。纯刚玉中的所有电子皆已配对,对白光无吸收,所以呈无色。但引入Cr3+后,有未配对电子。当可见光照射红宝石时,对短波长的光有吸收而呈红色,这就是红宝石颜色的来源。
在掺入外来原子时,杂质原子分别进入基体的相应位置。这与在水里溶解盐,形成溶液的情形相似。而且整个体系最后是以固体的形式存在,故我们把它称作固体溶液,简称固溶体(solid solution)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







