上文介绍了一些典型的晶体结构。这些结构之间看似无关,实则有千丝万缕的联系。类质同象与同质多象是这些结构产生联系的纽带。
类质同象与同质多象是晶体结构中经常存在的现象。我们已在硅酸盐晶体结构一节介绍过类质同象。它是晶体中的某种质点被其他类似质点所取代,而晶体结构类型保持不变的现象。因此,类质同象把不同成分的晶体通过相同结构联系起来了。链状、层状、架状硅酸盐结构的[SiO4]中的Si常常被Al取代就属于这种情况。
同质多象(polymorphism)也叫多晶型,是指化学组成相同,在不同热力学条件下形成不同的晶体结构。因此,同质多象把不同晶体结构通过相同成分联系起来了。对不同的多晶型,人们常按它们形成的温度从低到高命名为α、β等类型,如α-石英与β-石英、α-Fe与γ-Fe,还有大家早就熟悉的金刚石和石墨都属于这种现象。如果我们把原子做无序排列或有序排列,则会形成不同结构,产生同质多象,如图3.15所示的β-CuZn与β′-CuZn。
同质多象中的每一种变体都有各自的热力学稳定条件。温度引起的转变如图3.36所示。通常,温度升高,原子的活动范围增加,所以同质多象朝配位数和相对密度都降低的变体转变。压力增加,同质多象朝配位数和相对密度都增加的变体转变。而变体周围的环境,如成分、杂质和酸碱度对同质多象变体的形成也有影响。例如ZnS的闪锌矿和纤锌矿结构,当含有质量分数在17%左右的Fe时,它们之间的转变温度从1020℃降为880℃。
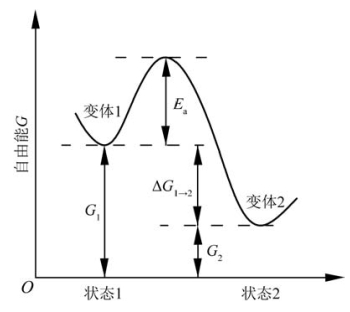
图3.38 同质多象转变势垒示意图
从能量观点来看,在封闭体系中,当物理化学条件改变时,变体相对于该条件能稳定存在的自由能与先前的自由能相比,发生了变化。如图3.38所示,设变体1在状态1时的自由能为G1,变体2在状态2时的自由能为G2。若ΔG1→2=G2-G1<0,则变体1有自动向变体2发生同质多象转变的趋势。但转变的快慢及转变是否能发生则与转变要越过的势垒Ea的大小有关。而晶体结构会影响Ea:若两个变体的结构差异小,则Ea小,转变容易,如α-石英与β-石英;若两个变体的结构差异大,则Ea大,转变不容易,如石英与鳞石英。在某些情况下即使ΔG1→2<0,也存在不能越过势垒而发生转变的情形。这时变体1就长期处于亚稳态。这就是热力学不稳定,而动力学稳定,如我们通常见到的窗户玻璃,有自动结晶的趋势,但使用很多年直到它破损后都还未结晶。
同质多象还有一种特殊形式——多型。它是一种元素或化合物在原子、离子或分子堆砌成晶体的过程中,有两种或两种以上堆积层结构的现象。它们的基本堆积方式相同但重叠顺序不同,从而产生多种变体。在3.2.2节原子的等径球密堆中,我们知道有ABABAB…和ABCABC…两种堆积方式。A、B、C三种基本堆积层可组成不同的重复周期从而产生多型现象,比如ZnS的阴离子以ABC为重复周期做堆砌就是闪锌矿结构,多型用3C表示;阴离子以AB为重复周期做堆砌就是纤锌矿结构,多型中用2H表示。纤锌矿结构中,还有以ABCB为重复周期,用4H表示;以ABCBCACAB为重复周期,则是9R多型。纤锌矿还有其他堆积方式。在多型的表示符号中,数字表示重复周期的层数,拉丁字母表示晶系,C(立方)、H(六方)、R(三方菱面体格子)、Q(四方)、O(正交)、M(单斜)。石墨有2H、3R两种多型。3R型石墨的原子排列更接近金刚石,故用它来合成金刚石更合适。(注:此处晶系的符号与表3.1不同。为区分堆积层中的A、B、特别是C层的符号,多型中晶系的符号用大写且倾斜的拉丁字母表示)
那成分和结构都不同的晶体又有何联系呢?我们已知原子在堆砌时会产生四面体、八面体、立方体等空隙。在这些空隙中,按照不同方式填入一些原子,就会演变出另一种结构。比如在等径球面心立方密堆结构中,另一些原子填入全部八面体间隙后,NaCl型结构就形成了。同样在面心立方密堆结构中,其一半的四面体间隙有序填入另一些原子后就成了闪锌矿型;而全部四面体间隙被另一些原子填入,则为萤石型;两种离子有序填入全部四面体间隙后的结构为CuMgSb型。
了解晶体结构之间的这些联系,可以为我们合成具有某种性能的结构奠定一定基础。因为先进无机材料,特别是功能材料,是结构敏感的。所谓结构敏感是指晶体结构有细微变化,就能引起晶体物理性质的显著改变,如白宝石、红宝石与蓝宝石。我们可以用一种或多种合适的原子按照不同比例做类质同象取代;改变温度、压力等条件产生多晶型结构;或填充不同种类和数量的空隙产生不同结构等。这些为我们采用如掺杂等方式对结构进行改制提供了一些思路,也为我们研发新材料、改进现有材料的性能提供了一种途径。(https://www.daowen.com)
本章结语
我们以刚性球模型为基础,介绍了原子通过堆砌而形成一定的晶体结构。原子的相对大小、离子的极化和电负性等因素会导致结构的变化。许多晶体结构看似不同,实则有一定的联系。这些联系及差异为材料研发指明了一些方向。然而,在介绍这些晶体结构时,我们默认其原子严格按照晶体对称性和周期性而排布。也就是说每种晶体结构都处于理想状态。事实上,晶体结构往往并非处于理想态:有些原子的位置或被其他原子占据着,或空着。但正是这些偏离理想结构的晶体赋予了材料多姿多彩的性能,如半导体和钢铁。
推荐读物
[1]Geim A K,Novoselov K S.The rise of graphene[J].Nature Materials,2007,6(3):183-191.
[2]章永凡,林伟,王文峰,等.3d过渡金属碳化物相稳定性和化学键的第一性原理研究[J].化学学报,2004,62(11):1041-1048.
[3]Davis R J,Pearce R,Hume-Rothery W.The structure of anα/βbrass[J].Acta Crystal,1952,5:36-38.
[4]刘东亮,金永中,邓建国.超高温陶瓷材料的抗氧化性[J].陶瓷学报,2010,31(1):151-157.
[5]叶大年,布沙诺夫斯基D,施倪承,等.论硅酸盐晶体结构中配位多面体的功能性替代[J].中国科学(D辑),2001,31(11):938-943.
[6]蒋平.层状结构化合物研究的进展[J].物理学进展,1982,2(2):202-227.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






