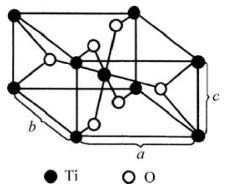
金红石(TiO2)型晶体的结构如图3.19所示。它属于四方晶系、简单四方格子。空间群P42/mnm,其Strukturbericht符号为C4,Pearson符号为tP6,Z=2。我们可把该结构看作是O做近似六方紧密堆积。Ti位于变形的八面体空隙中而构成[TiO6]八面体,但Ti只占据一半的八面体空隙。晶胞中Ti的坐标(0,0,0)、(0.5,0.5,0.5);O的坐标(0.31,0.31,0)、(0.69,0.69,0)、(0.81,0.19,0.5)、(0.19,0.81,0.5)。具有这种结构的晶体主要有金红石、SnO2、WO2、PbO2。
TiO2有三种常见的晶型:金红石型(rutile)、锐钛矿型(anatase)和板钛矿型(brookite)。其中,金红石分布最广、结晶状态稳定。金红石的晶格常数a=b=4.59Å,c=2.96Å。
TiO2是冶炼金属Ti的矿物原料。Ti合金广泛用于军工、航空航天技术。冶炼金属Ti可用氯化冶金的方法。Ti与氯元素结合形成易挥发的TiCl4。TiCl4挥发而与脉石分离。回收后的TiCl4经Mg在一定温度下还原得到金属Ti。该反应过程示意如下:(www.daowen.com)
![]()
金红石的介电常数高。因此,金红石瓷成了一种利用较早的高介电材料而用作无线电电容器陶瓷。金红石的折射率也很大(达到2.6~2.9),故可被用于制备光学材料。它也常用于陶瓷工业的乳浊剂以增强釉的遮盖能力。
锐钛矿结构的TiO2加热到550~1000℃时可转变为金红石型TiO2。锐钛矿型TiO2的光催化能力较强而常被作光催化材料。这种光催化材料可去除水和空气中的污染物,也可在陶瓷上形成自清洁表面。TiO2在工业中通常称作钛白粉。钛白粉可用于油漆、涂料的白色颜料及纸张填料。
金红石结构的SnO2(Tin dioxide),其晶格常数a=b=4.74Å,c=3.19Å。SnO2是一种半导体材料,禁带宽度为3.6 eV。SnO2陶瓷是最常见的气敏材料之一,1968年就已经商品化。加入一定催化剂的SnO2陶瓷,可检测某些气体。比如加微量PdCl2的SnO2陶瓷可检测CH4、CO;加微量Pt的SnO2陶瓷可检测CO。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







