NaCl型或岩盐结构(rock salt)见图2.26。它属于面心立方点阵、等轴晶系,空间群为Fm3m。其Pearson符号为cF8,Strukturbericht符号为B1。我们可以这样理解该型结构:半径大的离子做立方紧密堆积,半径小的离子填充在全部八面体空隙中。每个晶胞有8个原子,4个NaCl“分子”,即Z=4。晶胞中原子的位置:Cl(0,0,0)、(0,0.5,0.5)、(0.5,0,0.5)、(0.5,0.5,0);Na(0.5,0.5,0.5)、(0.5,0,0)、(0,0.5,0)、(0,0,0.5)。这种结构中的键力在三维方向上的分布较均匀,故NaCl型晶体无明显解理。该结构很少产生衍生结构。过渡金属因外层电子多,很难形成化学计量的化合物,如正离子缺位Ni1-xO、Co1-xO;正离子间隙Zn1+xO、Cd1+xO。常见NaCl型结构的晶体及其晶胞参数见表3.3。
表3.3 常见NaCl型结构的晶体及其晶胞参数
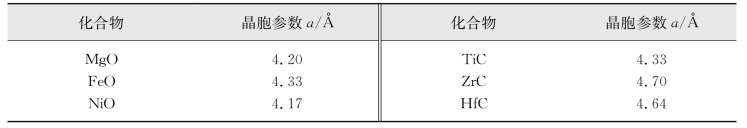
(引自Kobayashi,2001;Zaoui,2005和陆佩文,1991)(https://www.daowen.com)
续表

MgO(Magnesium oxide)。Mg2+填充在氧离子的全部八面体空隙中。MgO可从矿物(菱镁矿MgCO3)和海水中获取。MgO的密度为3.58 g/cm3;熔点高达2800℃,但在2300℃以上易挥发,因此MgO制品常在2200℃以下使用;MgO陶瓷有良好的电绝缘性;MgO属于弱碱性物质,几乎不被其他碱性物质所侵蚀;它对碱性金属熔渣有较强抗侵蚀能力,与许多金属如Fe、Ni、Zn、Al、Cu、Mg等不产生作用,故常用作冶炼这些金属的坩埚;MgO还可作热电偶保护管、镁质耐火材料;MgO瓷也常用作某些镁质功能陶瓷的主晶相,但MgO瓷在潮湿空气中易潮解。
过渡金属的碳、氮化物(主要是Ti、Zr、Hf、V、Nb、Ta的单碳化物和单氮化物)可以看作是金属离子做紧密堆积,C、N原子填充在全部八面体空隙中。由于金属离子间有一定的键合作用,所以它们的碳、氮化物呈现一定的金属性。此外,它们也具有较强的离子性和共价性。这些键性赋予了过渡金属碳、氮化物许多优良的性能,如高硬度、高熔点、导电性好等。过渡金属的碳、氮化物常用于耐磨、耐蚀涂层,机械加工的切削工具及微电子领域,尤其是HfC、TaC的熔点接近4000℃,而被看作是潜在的超高温陶瓷材料。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







