图3.11为金刚石型晶体结构,图3.11(b)是图3.11(a)的俯视图。它属于面心立方点阵fcc,空间群为Fd3m。其Strukturbericht符号为A4,Pearson符号为cF8,Z=8。该结构可看成是在Cu型结构的基础上增加了4个原子。图3.11中的1、2、3、4即为增加的原子。设图中A原子坐标为(0,0,0),则这四个原子的分数坐标分别是(0.25,0.25,0.25)、(0.75,0.75,0.25)、(0.25,0.75,0.75)、(0.75,0.25,0.75)。这种结构不是最紧密堆积,堆积系数ξ=0.34。属于这种结构的主要有金刚石、Si和Ge。
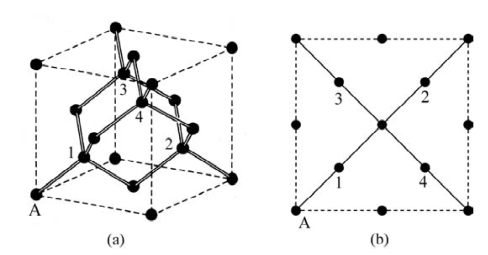
图3.11 金刚石型晶体结构示意图[图3.11(b)为图3.11(a)的俯视图](引自Kittle,2005)
金刚石的晶格常数a=b=c=3.567Å,密度为3.15~3.53 g/cm3。提起金刚石,读者可能会首先想到钻石。宝石级金刚石经人工琢磨成各种多面体后就成为钻石。金刚石是碳的亚稳定态,即常温、常压下不稳定,有自动向稳定态转变的趋势。(www.daowen.com)
金刚石中的C以共价键(sp3杂化)与周围4个C相连,键角为109°28′,形成四面体配位。C—C键强大。金刚石晶体中无自由电子。其结构特征赋予其高硬度、熔点可达4500K、热导率大(300K时,达900~2320 W·m-1·K-1)的特点,它比Ag的热导率还大(Ag的热导率约430 W·m-1·K-1)。
金刚石有很高的经济价值。宝石级金刚石,人们主要利用它的高硬度、光彩诱人的色泽。南非的金伯利城因1871年发现钻石而建立,城名则取自当时英国驻南非总督Kimberley伯爵。金伯利是世界上著名的钻石中心,其最大的金伯利矿早在1914年就已关闭。人们还用工业级金刚石制作仪表轴承、玻璃刀、金刚石薄膜、散热片等;利用其半导性(能隙5.47 eV)制作整流器和三极管。
当今典型的信息材料——Si(Silicon)属于金刚石型晶体结构。它是典型的半导体材料。1948年之前,人们对Si半导性的研究还处于零散状态。因Si的带隙为1.1 eV,比Ge的带隙0.67 eV宽,这样可防止温度升高时,有大量电子进入导带而使半导体的性能下降。因而在开始研究半导体时,人们就认为Si比Ge好。但由于当初半导体Si所需的纯度比Ge高得多,且冶炼Si的温度高达1451℃(Ge为937℃)等原因,人们采用的晶体管材料主要是Ge。后来,由于提纯Si的技术取得进展,加上Si表面的氧化物稳定、耐高温等原因,半导体材料由Ge转向了Si。如今,我们已离不开Si了,如手机、电脑中的芯片材料。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






