金属化合物是合金组元间相互作用所形成的一种晶格类型及性能均不同于任一组元的固相,一般可用分子式大致表示其组成。金属化合物一般有较高的熔点和硬度以及较大的脆性。金属化合物也可以溶入其他元素的原子,形成以金属化合物为基的固溶体。合金中出现化合物时,可提高强度、硬度和耐磨性,但会使塑性降低。根据金属化合物的形成规律及结构特点,常见的金属化合物可分为正常价化合物、电子化合物和间隙化合物3类。
3.1.2.1 正常价化合物
正常价化合物通常由金属与ⅣA、ⅤA、ⅥA族的一些元素生成,其特点是符合一般化合物的原子价规律,成分固定,并可用化学式表示,一般有AB、A2B、A3B三种类型,如Mg2Pb、Mg2Sn、Mg2Si、ZnS等。
正常价化合物的组元电负性相差较大,周期表中位置相距较远。两组元电负性相差越大,组成的化合物就越稳定。如Mg2Si的熔点为1 102 °C,而Mg2Sn为778 °C,Mg2Pb为550 °C。
正常价化合物组元的电负性差将决定新相结合键的性质。电负性相差较大的化合物具有离子键,如MgS为典型离子化合物;电负性较为相近的PtSn具有较强的金属键,由此有显著的金属性质。
3.1.2.2 电子化合物
电子化合物是由ⅠB族或过渡族元素与ⅡB、ⅢA、ⅣA、ⅤA族元素结合而成的。它们不遵循原子价规律,但服从一定的电子浓度规则。电子浓度是指合金中化合物的价电子数目与原子数目的比值,即电子浓度 。
。
电子化合物的晶体结构取决于合金的电子浓度,例如,电子浓度为3/2时,为体心立方晶格,称为β相;电子浓度为21/13时,为复杂立方晶格,称为γ相;电子浓度为7/4时,为密排六方晶格,称为ε相。
电子化合物可以用化学式表示,但其成分可以在一定范围内变化,因此可以把它看成是以化合物为基的固溶体,如 Cu-Zn合金中的CuZn(β相),其中Zn的含量为36.8%~56.5%。在有色金属材料中,电子化合物是重要的强化相。
电子化合物具有高的熔点和硬度,塑性较低,但若能与固溶体基体配合,能使合金特别是有色金属合金获得较好的强化效果。(https://www.daowen.com)
3.1.2.3 间隙化合物
间隙化合物一般是由原子直径较大的过渡族金属元素(Fe、Cr、Mo、W、V等)与原子直径较小的非金属元素(H、C、N、B等)所组成的。其构成不遵守原子价规则,而是受原子尺寸因素所控制。
根据组成元素原子半径比值和晶体结构特征,间隙化合物又可分为间隙相和间隙化合物两类。
1.间隙相
当非金属原子半径与金属原子半径比值小于0.59时,形成具有简单晶格的间隙化合物,称为间隙相,如TiC、TiN、ZrC、VC、NbC、Fe2N等。间隙相具有极高的熔点、硬度和脆性,而且十分稳定。它们的合理存在,可有效地提高钢的强度、热强性、红硬性和耐磨性,是高合金钢和硬质合金中的重要组成相。
2.间隙化合物
当非金属原子半径与金属原子半径的比值大于0.59时,形成的化合物具有复杂的晶体结构,称为间隙化合物。间隙化合物也具有很高的熔点、硬度和脆性,但比间隙相要稍低一些,加热时也易于分解,如钢中的Fe3C、Cr23C6、Fe4W2C、Cr7C3、Mn3C等。Fe3C是铁碳合金中的重要组成相,它具有复杂的斜方晶格。如图 3.3 所示,其中铁原子可以部分被锰、铬、钼、钨等金属原子所置换,形成以间隙化合物为基的固溶体,如(Fe、Mn)3C、(Fe、Cr)3C等。
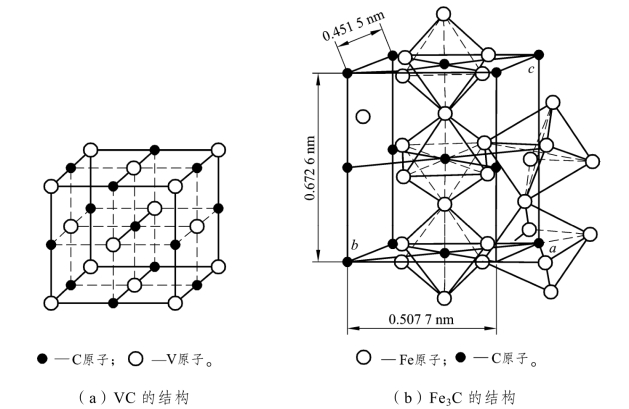
图3.3 间隙化合物的结构
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







