(一)热过程的方向性
由日常生活和工程实践可知,自然界中发生的一切热过程都具有方向性。例如,如图1-11所示,在一个密闭的、绝热的刚性容器中盛有定量的某种气体,并有一由重物升降装置带动的搅拌器。重物下降做功,使搅拌器转动,通过搅拌,气体温度升高。但反过来,气体温度降低,却不能使搅拌器转动带动重物上升。由此说明,机械能可以自发地、全部地转变为热能,而热能却不能自发地转变为机械能。另外,热能可以自发地从高温物体传向低温物体,但要使热能由低温物体传向高温物体必须付出代价。
以上现象说明热过程具有方向性,即只能自发地向一个方向进行,如果要逆行,就必须付出某种代价,要具备一定的补充条件。
(二)热力学第二定律的表述
热力学第二定律就是要揭示自然界中一切热过程进行的方向、条件和限度。
克劳修斯表述:热不可能自发地、不付代价地从低温物体传至高温物体。
开尔文表述:不可能制造出从单一热源吸热、使之全部转化为功而不留下其他任何变化的热力发动机。
热力学第二定律又可表述为:第二类永动机是不可能制造成功的。
(三)卡诺循环
卡诺循环是工作于温度分别为T 1和T 2两个热源之间的正向循环,由两个可逆定温过程和两个可逆绝热过程组成。工质为理想气体时的p—v图和T—s图如图1-12所示。
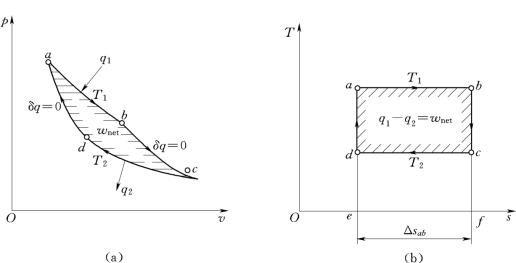
图1-12 卡诺循环
(a)p—v图;(b)T—s图
卡诺循环的热效率为
![]()
分析卡诺循环热效率公式,可得出如下几点重要结论:(www.daowen.com)
(1)卡诺循环的热效率只决定于高温热源和低温热源的温度T 1、T 2。
(2)卡诺循环的热效率只能小于1。
(3)当T 1=T 2时,循环热效率ηc=0。即第二类永动机是不存在的。
(四)卡诺定理
定理一:在相同的高温热源和低温热源间工作的一切可逆热机具有相同的热效率,与工质的性质及循环形式无关。
定理二:在相同的高温热源和低温热源间工作的一切不可逆热机的热效率,都小于可逆热机的热效率。
(五)熵及孤立系统熵增原理
1.熵
熵是状态参数,用符号S表示,单位为J/K,定义式为
![]()
式中 δQ——可逆过程的换热量,J;
T——热源温度,K。
单位质量工质的熵称为比熵,用符号s表示,单位为J/(kg·K),表达式如下
![]()
2.孤立系统的熵增原理
在孤立系内,一切实际过程都朝着使系统熵增加的方向进行,对于可逆过程维持系统的熵不变,而任何使系统熵减小的过程是不可能发生的。这一原理称为孤立系统的熵增原理。孤立系统的熵增原理是热力学第二定律又一种表述,通过它可以对热过程进行的方向、条件和限度进行分析。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






