常见的用于层状富锂锰基材料表面包覆改性的无机物包括电化学惰性的(如Al2O3,AlPO4,SiO2,ZnO,CeO2,ZrO2)和电化学活性的[如LiMPO4(M=Ni,Co),MnO2等]。包覆改性的意义在于减少富锂材料与电解质的副反应,抑制材料结构由层状向尖晶石的转变,并保留富锂层状结构在充电过程中衍生的氧空位。从而有效提升富锂层状材料的比容量、循环性能和倍率性能等。
1.Al2O3包覆
Manthiram小组[51,52]使用Al2O3对Li[Li0.2Mn0.54Ni0.13Co0.13]O2进行表面包覆改性,具体数据如表5-8所示,Al2O3包覆后材料的首次放电比容量从改性前的250 mAh·g-1提高到280 mAh·g-1,不可逆容量损失减少35~50 mAh·g-1。
Manthiram小组[52]采用3% Al2O3对三元富锂材料(1-z)Li[Li1/3Mn2/3]O2·(z)Li[Mn0.5-yNi0.5-yCo2y] O2 (0≤y≤0.5和0.25≤z≤0.75)进行表面包覆处理,结果发现,材料首次循环过程中的不可逆容量有所减少,除y=1/3,z=0.25以外,其他材料30次循环容量保持率有所增加;接下来对y=1/6,z=0.4和y=1/3,z=0.4 的(1-z)Li[Li1/3Mn2/3]O2·z Li[Mn0.5-yNi0.5-yCo2y]O2材料分别采用3%的CeO2,ZrO2,SiO2,ZnO和AlPO4包覆和F- 掺杂处理,所有改性材料的充、放电曲线如图5-31所示,从图中可以发现材料的首次不可逆容量下降,放电比容量有所上升,但除Al2O3包覆和F-掺杂与原材料容量保持率类似外,其他表面处理材料的容量保持率有所下降;Li2O从材料中脱出引发的过渡金属离子迁移和氧的流失而生成新的无缺陷的层状MnO2被认为是导致首次不可逆容量的主要原因,氧化物的表面包覆处理能够有效地保留氧流失造成的氧空位,从而提高材料的充、放电比容量。特别发现,用Al2O3和AlPO4进行表面改性可有效保留更多的氧化物离子空位并抑制不可逆容量(Irreversible Capacity,IRC)值。图5-32比较了Al2O3,ZrO2,ZnO,AlPO4等包覆材料及F-掺杂对正极材料的性能影响,研究发现,经Al2O3包覆的正极材料具有更好的循环性能。
表5-8 Al2O3包覆前后,在C/20,2.0~4.8 V条件下循环的层状正极材料的电化学电池数据[52] mAh·g-1
2.在富锂材料表面形成快离子导体
Wu等[53]利用不同浓度(0~4%,质量分数,下同)的 AlPO4对Li1.2Mn0.54 Co0.13Ni0.13O2富锂材料进行了表面包覆改性。如图5-33所示,用AlPO4进行表面改性后,材料的首周充电电压略有增加,而放电电压有所下降,这可能是由绝缘的表面改性材料引起的电阻率增加所致。
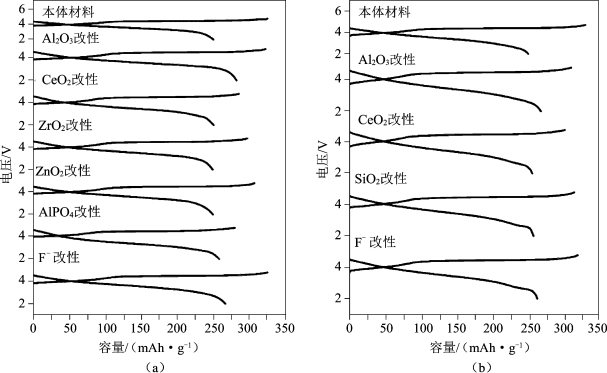
图5-31 用不同氯化物表面包覆的(1-z)Li[Li1/3Mn2/3]O2·z Li[Mn0.5-yNi0.5-yCo2y]O2的首次充放电曲线
(a)y=1/6和z=0.4以及(b)y=1/3和z=0.4的材料在用3%Al2O3,CeO2,ZrO2,SiO2,ZnO和AlPO4和0.05原子F-进行表面改性前后的首次充、放电曲线比较[52]
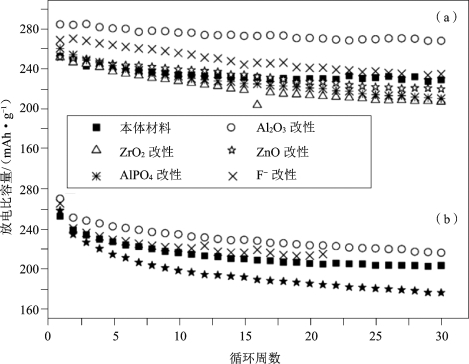
图5-32 用不同氧化物改性的(1-z)Li[Li1/3Mn2/3]O2·z Li[Mn0.5-yNi0.5-yCo2y]的循环性能
(a)y=1/6和z=0.4以及(b)y=1/3和z=0.4的样品在用3%的Al2O3,CeO2,ZrO2,ZnO,AlPO4和0.05原子F-进行表面改性前后的可循环性比较[52]
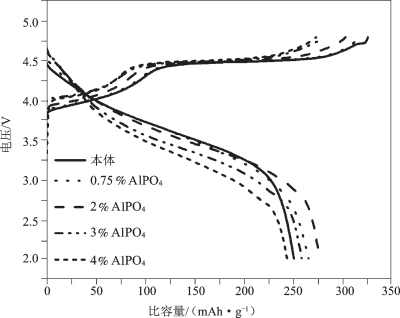
图5-33 Li[Li0.2Mn0.54Ni0.13Co0.13]O2在用各种量的AlPO4进行表面改性前后(400 ℃退火)的首次充、放电曲线[53]
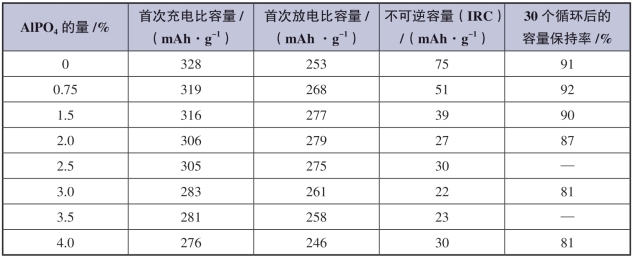
图5-34比较了利用不同含量的AlPO4进行表面改性后,各样品的循环能力,可以明显看出,当AlPO4的含量大于2%时,材料的循环稳定性显著降低。表5-9中具体给出了各含量AlPO4改性并在400 ℃下退火后的首次充、放电比容量值以及IRC值。当AlPO4含量增加到4%时,首次充电比容量从328降低到了276 mAh·g-1,而首次放电比容量却有所增加,且在AlPO4为2%时达到最大(279 mAh·g-1),IRC值随着AlPO4含量的增加而显著下降。
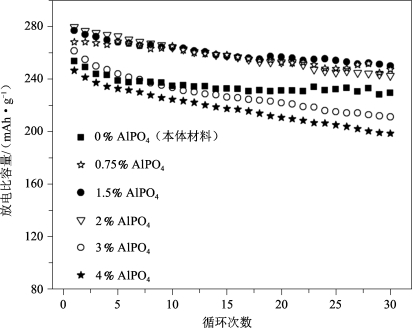
图5-34 Li[Li0.2Mn0.54Ni0.13Co0.13]O2在用各种量的AlPO4进行表面改性前后(400 ℃退火)的循环能力[53]
表5-9 层状Li[Li0.2Mn0.54Ni0.13Co0.13]O2材料在用各种量的AlPO4进行表面改性前后(400 ℃)下退火的电化学数据[53]
改性材料电化学性能的提升是由于AlPO4表面包覆可以在材料表面上形成Li3PO4,并将一些Al3+掺入层状晶格中,形成的Li3PO4相可由XRD图证实(图5-35)。与未改性的样品相比,表面改性的样品表现出更高的放电比容量和更低的不可逆容量损失。同时,包覆表面改性的样品中保留了更多的氧化物离子空位。在循环过程中,会逐渐消除首次充电后晶格中存在的氧化物离子空位,所以AlPO4修饰的正极材料容量衰减缓慢。
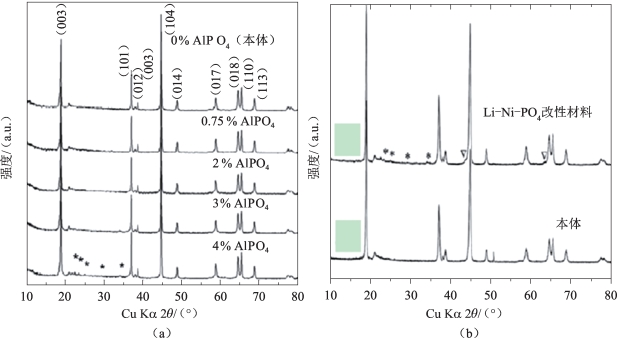
图5-35 (a)使用不同量(0~4%)的AlPO4表面改性并在400 ℃煅烧的Li1.2Ni0.176Co0.1Mn0.524O2 富锂材料的XRD 图谱及(b)原始和Li-Ni-PO4改性后的富锂材料 Li1.2Ni0.176Co0.1Mn0.524O2的XRD图谱(*代表Li3PO4相[53])
橄榄石结构的LiMPO4(M=Ni,Co)不仅具有稳定的结构,而且具有电化学活性,被认为是用来包覆其他电极材料的优良选择。Thackeray等[54]用LiNiPO4对xLi2MnO3·(1-x)LiMO2(M=Mn,Ni,Co)进行包覆。在包覆过程中,富锂材料的表面或近表面处的 Li 离子脱出与溶液中的磷酸根发生反应,伴随着 Li 离子的脱出导致其在富锂材料的颗粒表面形成大量的 Li 离子空位。包覆层中的部分Ni2+进入了富锂材料体相中,取代了Li层中的部分Li+,在材料的表面形成了具有缺陷结构的类似快离子导体Li3PO4的Li3-xNix/2PO4(0<x<1)层,这不仅能使Ni2+和Mn4+相互作用抑制富锂材料表面Mn3+的溶解,稳定材料结构,还能够提供Li+快速传输的导体。这使材料的倍率性能和循环稳定性都得到了改善。
未改性的原始材料和经过Li-Ni-PO4改性的电极的倍率性能如图5-36(a)所示。与原始的0.5Li2MnO3·0.5LiNi0.44Co0.25Mn0.31O2电极相比,经Li-Ni-PO4处理的电极在较高的放电电流下具有更大的耐受性;原始电极的容量保持率仅为70%,改性电极在0.1 mA·cm-2(C/11)时显示出较少的极化和80%的容量保持率。在该倍率下可提供250 mAh·g-1的可充电比容量,在0.5 mA·cm-2(C/2)下提供225 mAh·g-1的充电比容量,在1.0 mA/cm2(C/1)下提供200 mAh·g-1的充电比容量。由图5-36(b)可以看出,Li-Ni-PO4处理过的电极具有出色的循环稳定性,尤其在C/11倍率下。
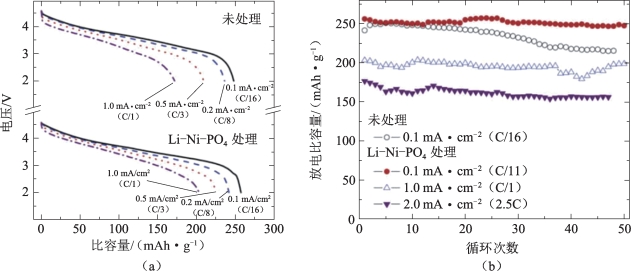
图5-36 原始材料和经LiNiPO4处理的0.5Li2MnO3·0.5LiNi0.44Co0.25Mn0.31O2电极的锂电池的电化学性能[54]
(a)不同倍率下的放电曲线(充电电流:所有循环均为0.1 mA·cm-2);(b)容量与循环次数的关系曲线,电压介于2.0和4.6 V之间(0.1~2.0 mA·cm-2)
Yuan等[55]提出了一种非晶/晶态Li3PO4的表面多相包覆工艺,通过湿化学法来解决富锂层状氧化物在高温下的循环和压降问题。该多相包覆包括非晶态Li3PO4和晶态Li3PO4包覆,分别起到了物理屏障和提高Li+扩散速率的作用。为了证明Li3PO4包覆层是否存在非晶态和晶态以及对富锂锰基正极材料(LRM)表面的影响,对改性样品LRM-3的微观结构进行了高分辨率透射电镜(HRTEM)表征(图5-37)。如图5-37(a)所示,改性后的本体区仍保持层状结构,表面的多相Li3PO4包覆层交错共存,快速傅里叶变换(FFT)图像也证实了这一点。此外,如图5-37(e)所示,所有的元素都均匀地分布在整个颗粒中,证明Li3PO4均匀包覆于富锂材料表面。该多相包覆层中,结晶态的Li3PO4可以增强Li+的界面扩散能力,非晶态的Li3PO4可以稳定晶体结构,这种独特的组合改善了富锂正极材料在高温下的电化学性能。在55 ℃的测试条件下,改性后的Li1.2Ni0.2Mn0.6O2首次库仑效率达到92%,循环稳定性也得到了显著提高,1 C循环100周后放电比容量为192.9 mAh·g-1。同时,电压衰减也受到抑制,每一周循环中的平均压降从5.96 mV降至2.99 mV。

图5-37 LRM-3的微观结构HRTEM图像[55]
(a)LRM-3的HRTEM图像;(b),(c),(d)对应矩形区域的放大图以及快速傅里叶变换(FFT)图像;(e)在LRM-3中Mn,Ni,O和P元素的EDS图像
杨泽亮等[56]用快离子导体LiAlO2对Li1.2Mn0.6Ni0.2O2(样品标记为LMR)材料进行包覆,极大地减缓了电压衰减速率,使材料在长循环中表现出优异的稳定性。杨探究了包覆量和煅烧温度对电极材料结构和性能的影响,研究发现,过高的包覆量(大于3%)会导致过厚的表面层,影响锂离子的界面迁移速率;过高的煅烧温度(高于450 ℃)极易导致锂量的减少和 NiO 型岩盐相结构的生成。而合适的包覆量和煅烧温度能够使正极材料表面拥有一层稳定且均匀的包覆薄层,同时在煅烧过程中部分 Al 离子能够扩散入材料表层晶格结构,在锂离子快速脱嵌过程中起到支撑作用,实现了材料的高比容量和高循环稳定性。电化学测试结果显示,包覆量约为 3%在450 ℃煅烧获得的材料(样品标记为MC3T450,其中3为包覆量,450为煅烧温度)具有最佳的综合电化学性能(图5-38、图5-39)。
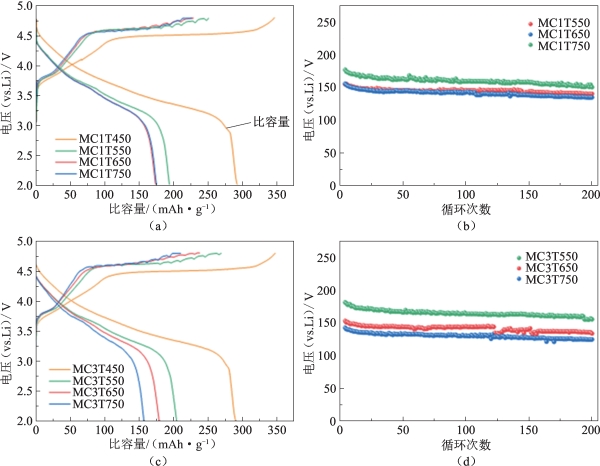
图5-38 1%和3% LiAlO2包覆量的Li1.2Mn0.6Ni0.2O2在不同煅烧温度,2~4.8 V的电化学性能[56]
(a)1% LiAlO2包覆量在首次循环的充、放电曲线;(b)1% LiAlO2包覆量在1 C下的循环性能;(c)3% LiAlO2包覆量在首次循环的充、放电曲线;(d)3% LiAlO2包覆量在1 C下的循环性能
3.欠锂态氧化物包覆
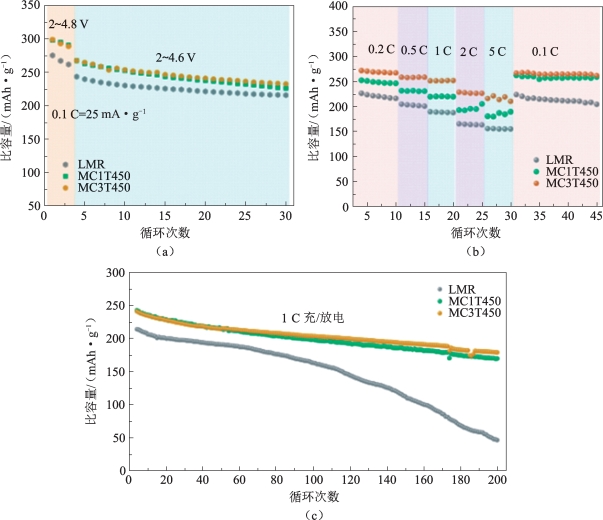
图5-39 LMR,MC1T450和MC3T450的循环性能
(a)0.1 C下循环性能;(b)多倍率循环性能;(c)1 C下循环性能[56]
一般氧化物包覆改性后的材料,其首次库仑效率的提升幅度有限(小于90%)。有研究发现,通过将具有嵌脱锂活性的欠锂态氧化物(如V2O5[57],LiV3O8,Li4Mn5O12[51]和MnOx[51,19]等)与富锂材料复合,可以使不能回嵌到富锂材料内部的锂离子嵌入这些嵌锂氧化物中,从而提高材料的首次库仑效率,或经过硝酸盐浸处理[58,59]使层状富锂锰基材料具有较高的库仑效率,但是材料循环稳定性难遂人意。
Wang等[60]通过简单的高能球磨过程制备了MoO3包覆的 Li1.2Mn0.54Ni0.13Co0.13O2颗粒(记为Li1.2Mn0.54Ni0.13Co0.13O2-MoO3),形成了致密的MoO3包覆层(图5-40),MoO3在放电过程中可以提供额外的Li+嵌入位点,以补偿Li1.2Mn0.54Ni0.13Co0.13O2材料中Li2MnO3组分在充电过程中同时脱出Li+和O2-而丢失的Li+嵌入位点。在放电过程中,原本不能回嵌到材料内部的Li+可以嵌入MoO3中,从而提高材料的首周库仑效率。而且,由于高能球磨有利于形成致密的无定形MoO3包覆层将Li1.2Mn0.54Ni0.13Co0.13O2与电解液隔开,有效地抑制了活性材料和电解液之间的副反应和循环过程中过渡金属离子的溶解,材料的循环稳定性得到了明显改善。

图5-40 原始材料和MoO3包覆材料的SEM图和TEM图
(a)Li1.2Mn0.54Ni0.13Co0.13O2 的SEM图;(b)Li1.2Mn0.54Ni0.13Co0.13O2-MoO3(5%)的SEM图;(c)Li1.2Mn0.54Ni0.13Co0.13O2-MoO3(5%)的TEM图[60]
如图5-41所示,Li1.2Mn0.54Ni0.13Co0.13O2-MoO3在首次放电过程中电压低于3.0 V时出现了MoO3的放电平台,并且随着复合量的不断增加该平台变宽。有趣的是,Li1.2Mn0.54Ni0.13Co0.13O2-MoO3的充电比容量却处于不断下降的趋势,但其放电比容量没有发生明显的变化,复合材料的首次不可逆容量损失逐渐减小,首次库仑效率不断提高。图5-42对比了不同MoO3包覆量的Li1.2Mn0.54Ni0.13Co0.13O2-MoO3复合材料的首周充电比容量、放电比容量、首次不可逆容量以及库仑效率。由图中数据可以看出,MoO3的包覆量由0%增加到20%,0.1 C下首周的不可逆容量损失由81.8 mAh·g-1降至1.2 mAh·g-1,库仑效率由76.9%上升至99.6%;当进一步提高MoO3的包覆量至30%时,其放电比容量比充电比容量高出27.8 mAh·g-1。同时,随着MoO3复合量的增加(质量分数由0%增加到30%),材料的充电比容量明显有所降低(353.7 mAh·g-1→246.4 mAh·g-1),而放电比容量基本保持不变(271.9 mAh·g-1→274.2 mAh·g-1)。
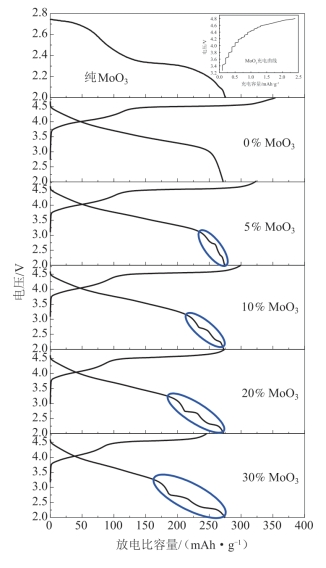
图5-41 MoO3及与不同量的MoO3复合的Li1.2Mn0.54Ni0.13Co0.13O2在0.1 C下的首次充、放电曲线[60]
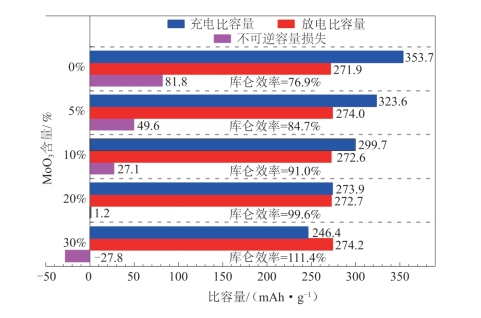
图5-42 与不同量MoO3复合的Li1.2Mn0.54Ni0.13Co0.13O2在0.1 C下的充、放电比容量和不可逆容量损失的变化[60]
通过图5-43中的首次充、放电微分容量曲线可以更好地理解Li1.2Mn0.54Ni0.13Co0.13O2-MoO3在首次充、放电过程中发生的电化学反应。在首次放电过程中,Li1.2Mn0.54Ni0.13Co0.13O2-MoO3复合物在2.2~2.8 V之间出现了两个明显的还原峰,对比发现,这两个还原峰与MoO3放电过程中的两个还原峰相对应。复合材料的不可逆容量损失的下降归功于复合材料中欠锂的MoO3作为锂离子的接收体接收了由氧流失造成的原本不能回嵌到材料晶格中的锂离子。实验结果与前期其他研究者的研究结果一致(例如将Li1.2Mn0.54Ni0.13Co0.13O2与V2O5,Li4Mn5O12和LiV3O8复合等[57])。
MoO3包覆量为5%的Li1.2Mn0.54Ni0.13Co0.13O2-MoO3材料具有突出的循环稳定性(图5-44),在0.1 C循环50次后的放电比容量为242.5 mAh·g-1,容量保持率达88.5%。MoO3包覆量超过5%以后,材料的循环性能随这个包覆量的增大而变差,Wang推断这可能是采用(NH4)6Mo7O24·4H2O通过热分解法制备得到的MoO3的自身循环性较差所造成的。
为了改善Li1.2Mn0.54Ni0.13Co0.13O2的倍率性能,Wang采用溶胶-凝胶法替代高能球磨法在Li1.2Mn0.54Ni0.13Co0.13O2表面形成了非晶态相与晶态共存的MoO3包覆层。由于晶态的MoO3在二维空间内无限扩展构成的层状结构,非常适合锂离子的嵌入和迁移,其嵌锂态 LixMoO3具有更高的电子传导和离子扩散能力,材料表面MoO3包覆层中的部分MoO3以晶态存在,可以提高材料的电子传导和离子传导能力,进而提高材料的倍率性能(图5-45)。同时,当MoO3的包覆量为3%时,晶态与非晶态MoO3共包覆的Li1.2Mn0.54Ni0.13Co0.13O2材料显示了最好的循环性能(图5-46),在0.1 C下循环50次后的放电比容量仍有251.6 mAh·g-1,容量保持率为91.9%,优于使用高能球磨法制备的完全无定形MoO3包覆的Li1.2Mn0.54Ni0.13Co0.13O2的最好数据。但是,用溶胶-凝胶法制备的MoO3包覆的Li1.2Mn0.54Ni0.13Co0.13O2材料的首次循环库仑效率不如用高能球磨法制备的材料的首次循环库仑效率。
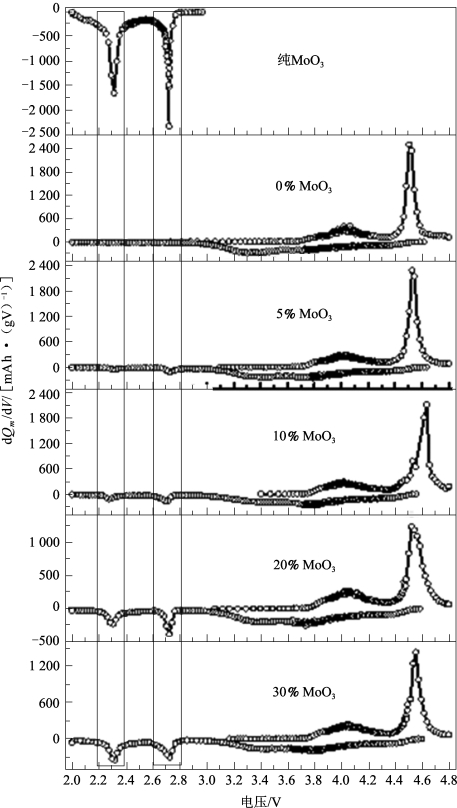
图5-43 MoO3及与不同量的MoO3复合的Li1.2Mn0.54Ni0.13Co0.13O2的dQm/dV曲线[60]
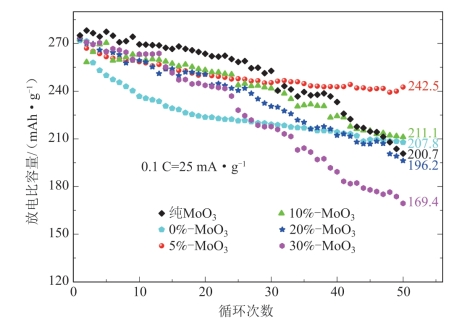
图5-44 MoO3及与不同量的MoO3复合的Li1.2Mn0.54Ni0.13Co0.13O2的循环性能[60]
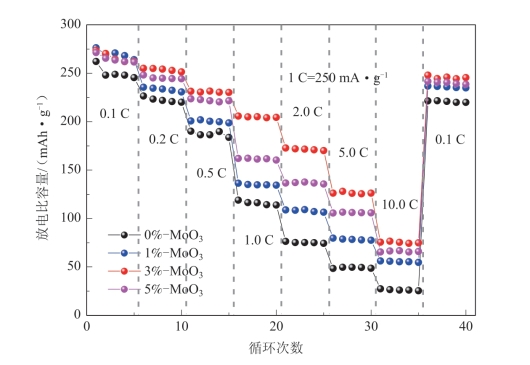
图5-45 表面具有不同含量非晶态相与晶态共存MoO3包覆层的Li1.2Mn0.54Ni0.13Co0.13O2的倍率性能[60]
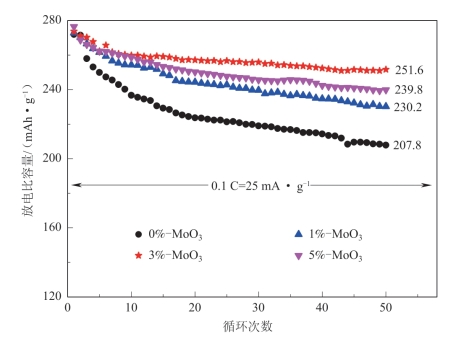
图5-46 表面具有不同含量非晶态相与晶态共存MoO3包覆层的Li1.2Mn0.54Ni0.13Co0.13O2的循环性能[60]
为了实现层状富锂锰基材料的首次库仑效率、比容量、循环性能和倍率性能的同时提升,Li[19]等拓展传统表面包覆概念,创新性地提出了以锰氧化物MnOx(1.5<x≤2)作为包覆介质,用“厚包覆”手段改性富锂锰基材料。锰氧化物MnOx(1.5<x≤2)是一种欠锂态氧化物,在充电过程中不具脱锂能力,但其有可能保留主体材料氧空位和嵌脱锂位;同时,具有电化学活性的厚包覆层MnOx本身也能提供嵌锂位,使得主体层状结构能在放电时获得更多锂位,从而有望提升层状富锂锰基材料的首次比容量和库仑效率,对材料的循环性能也有较大的改善作用。
不同包覆量的MnOx包覆改性样品zMnOx·(1-z)Li[Ni0.2Li0.2Mn0.6]O2(1.5<x≤2.0,0<z≤0.25)是通过将草酸盐共沉淀法合成的层状富锂锰基材料Li[Ni0.2Li0.2Mn0.6]O2与溶于乙醇的醋酸锰按照摩尔比分别为0.95 :0.05,0.9 :0.1,0.85 :0.15,0.8 :0.2和0.75 :0.25混合后反复研磨,并在马弗炉中450~500 ℃下煅烧后获得。为方便表述,将层状富锂锰基材料Li[Ni0.2Li0.2Mn0.6]O2和包覆改性材料zMnOx·(1-z)Li[Ni0.2Li0.2Mn0.6]O2进行简化标记:其中未改性材料Li[Ni0.2Li0.2Mn0.6]O2记为the Pristine(本体材料),0.05MnOx·0.95Li[Ni0.2Li0.2Mn0.6]O2记为CC(Conventional Coating,常规包覆),剩下的其他厚包覆样品zMnOx·(1-z)Li[Ni0.2Li0.2Mn0.6]O2(z=0.10,0.15,0.20,0.25)分别标记为TC1,TC2,TC3和TC4(TC——Thick Coating,厚包覆)。(www.daowen.com)
Li认为材料的表面微观结构如表面欠锂态MnOx的结晶度和包覆层厚度等均对包覆改性后的材料的电化学性能改善起到至关重要的作用。如图5-47所示,常规包覆材料CC表面包覆层厚度为6~8 nm,呈无定形态;厚包覆改性材料TC1表面的无定形态包覆层厚度达20 nm左右,明显厚于报道的常规包覆层的厚度。在材料的表面还发现一些结晶态的复合物,结晶态成分晶格条纹与尖晶石相(111)条纹一致。这种尖晶石结构的形成可能是后续包覆煅烧过程中锂离子和镍离子从本体材料中扩散至包覆层导致的[61]。为了证实这一结论,对材料颗粒进行元素能谱线扫描和沿线采点两种方法定量测试元素分布(图5-48),结果发现,材料颗粒表面锰元素的浓度要明显高于本体材料的锰元素浓度,证实包覆层MnOx确实存在;同时在包覆后材料的表面检测到镍元素的存在,证实了离子扩散的发生。

图5-47 材料的HRTEM图像
(a)本体材料;(b)TC1[19]
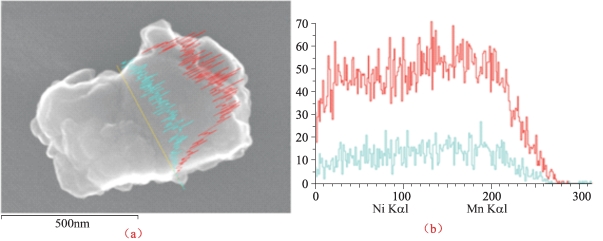
图5-48 沿着TC1颗粒投影表面线的能量色散X射线扫描(EDX)
(a)用于线扫描的特定颗粒的SEM图像;(b)观测到的Mn Kαl和NiKαl强度
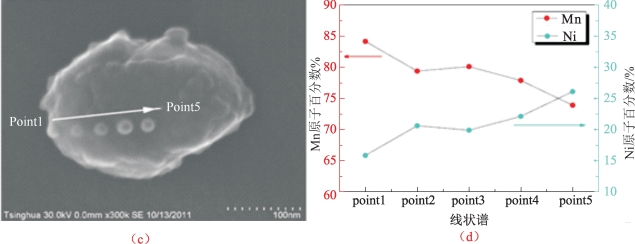
图5-48 沿着TC1颗粒投影表面线的能量色散X射线扫描(EDX)(续)
(c)用于线到点扫描的特定颗粒的SEM图像;(d)Mn和Ni的原子百分数定量分析[19]

图5-49 材料的XRD图[19]
(a)本体材料;(b)CC;(c)TC1;(d)TC2;(e)TC3;(f)TC4;(g)XRD局部放大图
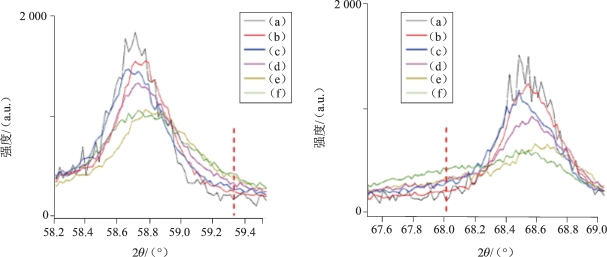
图5-49 材料的XRD图像(续)
(a)本体材料;(b)CC;(c)TC1;(d)TC2;(e)TC3;(f)TC4;(g)XRD局部放大图
XRD测试结果(图5-49)显示,包覆后的材料C/2m型Li2MnO3组分的超晶格衍射峰和R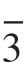 m型的层状结构呈现峰强逐渐变弱、峰宽变大的现象,特别是TC4样品,其超晶格几乎消失,这与无定形态MnOx的包覆层有关。此外,随着MnOx包覆量逐渐增加,除了(018)峰相对于(110)峰逐渐变强外,在2θ=36.5°,38.2°,59.3° 和 68.0°位置出现新的弱峰并逐渐变强,这可能与包覆层中结晶态尖晶石成分相关,这也与HRTEM中的观测结果一致。
m型的层状结构呈现峰强逐渐变弱、峰宽变大的现象,特别是TC4样品,其超晶格几乎消失,这与无定形态MnOx的包覆层有关。此外,随着MnOx包覆量逐渐增加,除了(018)峰相对于(110)峰逐渐变强外,在2θ=36.5°,38.2°,59.3° 和 68.0°位置出现新的弱峰并逐渐变强,这可能与包覆层中结晶态尖晶石成分相关,这也与HRTEM中的观测结果一致。
如图5-50(a)所示,包覆的材料在放电至3.0 V以下会出现一个平台,在原始材料中却没有这一平台,推断此平台极有可能是MnOx包覆层存在造成的。材料的充电比容量随着MnOx包覆量的增加逐渐降低,而放电比容量出现先显著提升,随后逐渐降低的现象;不可逆容量和首次库仑效率则分别递减和递增,其中当包覆量为25%时,样品首次库仑效率超过100%(表5-10)。
从微分容量曲线图5-50(c)发现,材料包覆过后不可逆容量显著降低,放电比容量增大,且首次库仑效率显著提升。从微分容量曲线中提供的信息可知,在充电过程中,在4.6~4.8 V虚线框位置出现微弱氧化峰,而在原始材料中没有出现这一氧化峰。此外,包覆后样品电池的开路电位明显高于原始材料,这可能也与欠锂态MnOx存在有关。在放电过程中,包覆改性CC样品和TC1样品出现的氧化峰分别在4.5~4.75 V和 2.7~2.95 V两个区域,如图中虚框所示。
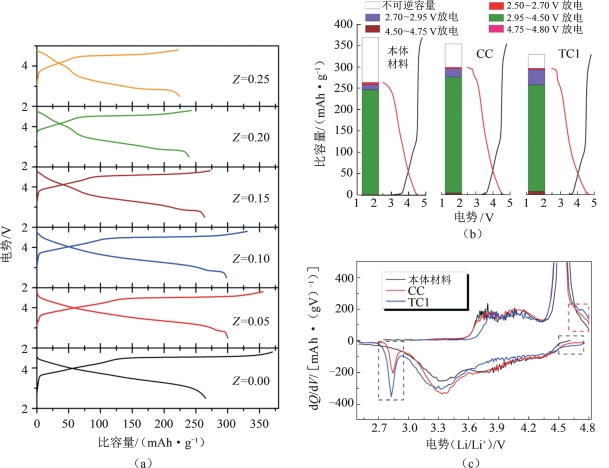
图5-50 (a)各样品的首次充、放电曲线和(b)本体材料、CC和TC1样品的首次充、放电曲线和容量柱状图及(c)三个样品对应的微分容量曲线[19]
表5-10 层状富锂锰基材料包覆前后首次循环电化学数据[19]
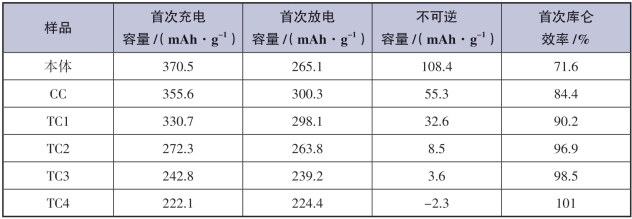
容量柱状图[图5-50(b)]有利于了解改性材料电化学性能改善的原因,放电柱状图按照微分容量曲线中出现的还原峰位置进行了划分,各分段比容量在图中清晰呈现。充电比容量随着包覆量的增加而降低。空白区域为各个样品不可逆容量,在包覆过后,CC样品和TC1样品的不可逆容量均显著降低。在2.7~2.95 V段、2.95~4.5 V段和4.5~4.75 V段,包覆改性样品CC和TC1比原始样品比容量更高。在2.7~2.95 V包覆量越高,样品比容量提升越多,说明此分段样品的比容量与包覆层MnOx有关。通过估算,MnOx平均放电比容量超过200 mAh·g-1,在放电区间4.5~4.75 V和充电区间4.6~4.8 V,表现出可逆氧化还原反应特征。而锰的氧化还原电位不可能达到此电压区段,因此电压区段的反应极有可能是尖晶石结构中Ni2+/Ni4+氧化还原,证实了尖晶石复合相LiMn2-xNixO4的存在,这也与XRD测试结果吻合。最后,2.95~4.5 V的电压区段比容量对应层状富锂锰基本体中Ni4+和Mn4+的还原反应过程,但此区段CC样品和TC1样品出现比容量的大幅提升,这是因为CC样品和TC1样品存在包覆物导致材料中Ni元素的含量有所降低,其电化学容量贡献变少,这一区段两种样品的容量提升主要来源于Mn4+的还原。因此,CC样品和TC1样品中在2.95~4.5 V区段的现象与微分容量曲线中包覆样品CC和TC1在2.95~3.5 V出现更大还原峰的现象一致。更多的Mn4+在包覆样品中还原,却没有在原始样品中还原,推断可能的原因是MnOx包覆层能保留在充电后期形成的氧空位,从而使一些锂空位得到相应的保留,在接下来的放电过程实现更多Li+的嵌入。
包覆样品CC和TC1的首次库仑效率和放电比容量提升的原因可归纳为:
(1)欠锂态氧化物MnOx充电时不具有活性,所以随着包覆量增加,其充电比容量变小;
(2)欠锂态氧化物MnOx放电时具备嵌锂活性,包覆量增加,其放电比容量相应增加;
(3)MnOx包覆层能保留材料的锂空位和氧空位,从而引导更多的Mn4+参与还原过程。
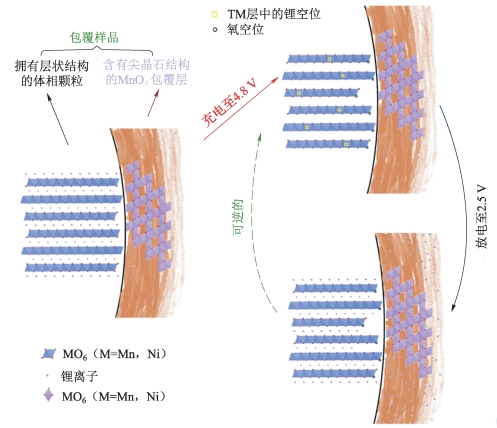
图5-51 MnOx包覆的材料的首次充、放电嵌脱锂原理示意图[19]
图5-51所示是MnOx包覆的材料在首次循环过程中的嵌脱锂原理示意图。包覆材料的组成包括本体部分的层状结构、包覆层中的欠锂态氧化物MnOx及一些微量尖晶石复合物。在充电过程中,锂离子从主体层状结构中的锂层和过渡金属层中脱出,分别形成锂空位和氧空位,但是在充电后期,材料主体结构出现不可逆的收缩重组,锂、氧空位逐渐消失,而MnOx包覆层的存在,使部分锂、氧空位得以保留,同时有少量锂离子从包覆层中的微量尖晶石结构嵌脱出来。放电过程中,锂离子不仅可以嵌入主体层状结构锂层,还能进入过渡金属层中保留下来的锂空位,此外,整个包覆层包括尖晶石复合相在内,均具有嵌锂活性,能回嵌较多的锂离子,从而有效地吸纳不可逆嵌出的锂离子,所以材料包覆后首次库仑效率能得到显著提升。另外,材料在放电过程中,所有回嵌的锂离子在理论上均能可逆嵌脱。
在循环稳定性方面,厚包覆样品TC1拥有最高的循环稳定比容量和容量保持率(88.9%)。对于原始样品来说,未修饰的材料表面易受电解液腐蚀和溶解,且易与电解液发生副反应,所以材料放电比容量衰减较快。对于常规包覆样品CC,虽然其首次放电比容量在所有材料中最大,但其容量衰减也最快,这可能是不足量的欠锂态氧化物MnOx未能充分修饰主体层状富锂锰基材料界面,导致锂、氧空位在循环过程中快速消失。而厚包覆材料TC1,30周循环稳定,在所有样品中有最高的稳定比容量265 mAh·g-1(图5-52),因此可以认为,厚包覆样品TC1循环性能改善的原因是,适量的包覆和合适厚度包覆层能有效阻隔主体层状颗粒与电解液在高电位环境下的直接接触,抑制材料中过渡金属离子的溶出,并保留主体层状结构中的锂、氧空位。
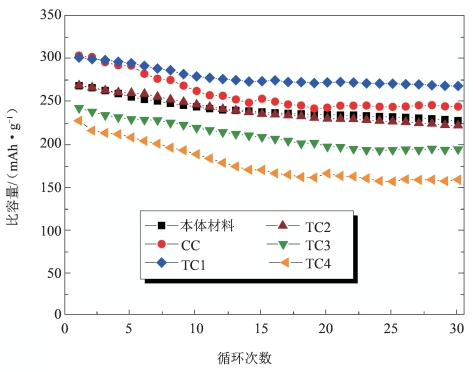
图5-52 所有样品的循环性能[19]
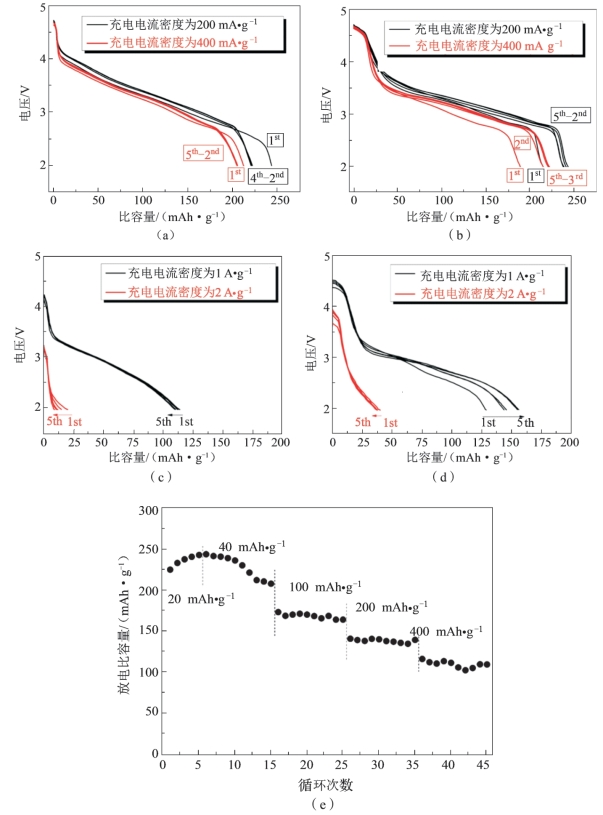
图5-53 所有样品的倍率性能[19]
(a)(c)常规包覆样品CC、(b)(d)厚包覆样品TC和(e)原始样品的倍率性能
图5-53对比了常规包覆样品CC和厚包覆样品TC1的倍率性能,两种材料均在0.1 C下充电,在1 C,2 C,5 C和10 C下放电,其中1 C=200 mA·g-1。结果表明,包覆后的样品均表现出比原始样品更优的倍率放电性能。虽然常规包覆样品CC在1 C和2 C下均表现出更高的首次放电比容量,但厚包覆样品TC1表现出更高、更稳定的比容量(CC:1 C时容量为221 mAh·g-1,2 C时为205 mAh·g-1;TC1:1 C时为 238 mAh·g-1,2 C时为 222 mAh·g-1)。厚包覆样品TC1比常规包覆样品CC在5 C和10 C下表现出更高的放电比容量,但是两种样品在高倍率下的容量衰减幅度要明显快于低倍率下。在两种样品放电曲线的前端和末端均出现了平台,这分别对应包覆层中尖晶石结构里Ni4+的还原和包覆层中欠锂态氧化物MnOx的还原,也与前述结论吻合。但是,此平台容量并未随测试电流密度增大而出现较大变化,这可能与尖晶石结构较好的离子电导率相关,亦可认为表面厚包覆层中尖晶石相复合物能改善主体材料的表面传质,从而提升材料的倍率性能。测试结果表明,厚包覆样品在小倍率放电时能保持好的可逆容量,但在大倍率循环下其性能尚有待提高。
4.碳材料包覆
利用碳包覆正极或负极材料是提高电极材料电化学性能最常用的方法,碳包覆能够有效地减少颗粒的团聚,增加材料表面的电子传导率。近几年的研究过程中,碳源向多样化发展,包含聚合物、碳纳米管、碳纤维、石墨烯等。碳纳米管一般直径在5 nm左右,长度可达10~20 μm,具有较大的长径比和良好的轴向平移不变性,被认为是理想的一维导电材料,一根碳纳米管的传导距离相当于几百甚至是几千个炭黑颗粒才能达到的传导距离;石墨烯是一种碳原子以sp2杂化轨道呈蜂巢晶格排列构成的单层二维材料,由于其电导性优异(16 000 S·m-1),可以在二维空间内发挥其良好的导电性能,同时石墨烯还具有巨大的比表面积(理论值为2 630 m2·g-1)和较高的机械强度(约1 100 GPa),被认为是理想的二维导电材料。碳纳米管(或石墨烯)不仅能够在三维导电网络中充当“导线”的作用,同时还具有双电层效应,能够发挥超级电容器的高倍率特性,其良好的导热性能还有利于电池充、放电时的散热,减少电池的极化,提高电池的高低温性能,延长电池的寿命。
富锂锰基正极材料的离子电导率和电子电导率较低,高倍率下充、放电性能不理想,这成为制约该类材料在推广应用中的主要障碍。有研究发现,对材料进行碳包覆可以显著提高材料的电子导电性,从而提高材料的倍率性能[62,63]。
Wang[64]等采用碳纳米管(CNT)通过水热法对层状富锂锰基材料Li1.2Mn0.54Ni0.13Co0.13O2(LMNCO)进行了包覆改性。如图5-54所示的SEM照片显示,与简单的物理混合相比,水热过程更能避免CNT的团聚,使CNT均匀紧密地包裹在材料表面,形成三维的CNT网络结构。这种紧密的包裹在材料表面的三维CNT网络结构,增加了活性材料之间的接触程度,可以提高电极整体的电导率,增强电极的倍率性能;同时还可以缓解充、放电过程中体积变化带来的应力,防止活性材料因体积膨胀和收缩形成“孤岛”,造成活性材料的损失,从而提高电池的循环寿命。但是,当CNT的复合量增加至5%时,CNT出现了较为明显的团聚。

图5-54 不同CNT复合量的样品的SEM图像[64]
(a)CNT为0;(b)CNT为1%;(c)CNT为2%;(d)CNT为3%;(e)CNT为4%;(f)CNT为5%;(g)物理混合4%CNT
对CNT包覆改性的LMNCO材料进行的电化学性能测试显示,与CNT复合后的复合材料的首次放电比容量均高于本体材料,推断是水热复合后形成三维CNT网络结构增强了材料之间的导电性所致。其中,CNT复合量为4%的水热复合产物展现出最高的放电比容量(图5-55)、最好的循环性能(图5-56)和最佳的倍率性能(图5-57)。当复合量为4%时,材料的首次放电比容量达到277.8 mAh·g-1,经过50次循环,其放电比容量依然高达253.5 mAh·g-1,容量保持率为91.25%(未包覆材料为75.6%)。
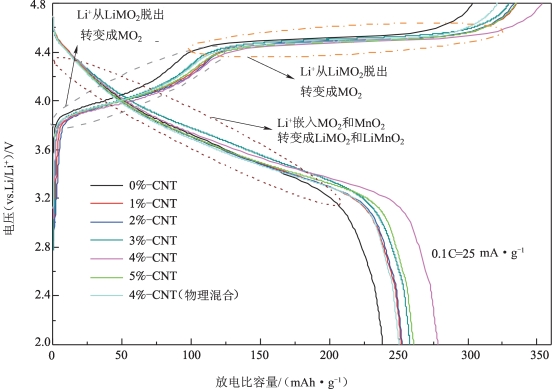
图5-55 不同CNT复合量的LMNCO材料的首次充、放电曲线[64]
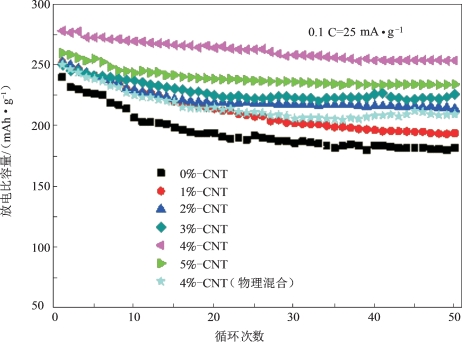
图5-56 不同CNT复合量的LMNCO材料的循环稳定性[64]
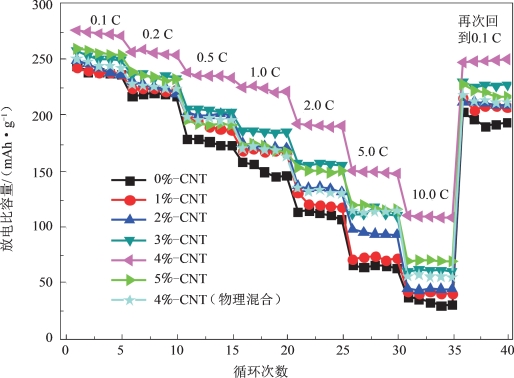
图5-57 不同CNT复合量的LMNCO材料的倍率性能[64]
Wang还采用石墨烯对富锂层状材料Li1.2Mn0.54Ni0.13Co0.13O2进行了包覆改性,其SEM图如图5-58所示。研究显示,适量的石墨烯包覆,能够将材料包裹在石墨烯层片中,形成良好的导电网络,并起到骨架支撑作用,使复合材料具有良好的结构稳定性,防止电解液对材料的腐蚀导致材料溶解流失,抑制SEI膜的形成,从而使包覆后的材料的循环稳定性(图5-59)和倍率性能(图5-60)较原始材料都得到改善。当复合量逐渐增大时,石墨烯出现团聚在一起(图5-58),将活性材料阻隔开来,延长了锂离子的传输路径,反而会对材料的电化学性能产生负面影响。
Song等[65]采用石墨烯通过湿法化学将富锂材料Li1.2Mn0.54Ni0.13Co0.13O2包覆改性(图5-61),所制备的复合材料在12.5 mA·g-1电流密度下的首周放电比容量达到313 mAh·g-1,在2 500 mA·g-1的大电流密度下仍能释放201 mAh·g-1的比容量。
5.金属Al包覆

图5-58 具有不同石墨烯添加量的Li1.2Mn0.54Ni0.13Co0.13O2材料的SEM图像[64]
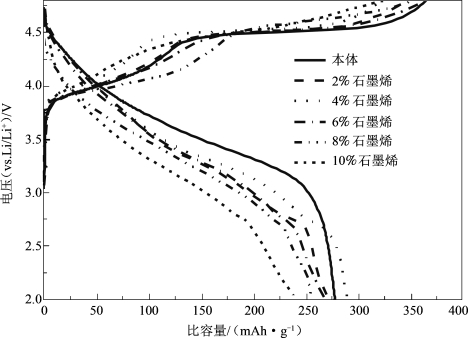
图5-59 具有不同石墨烯添加量的Li1.2Mn0.54Ni0.13Co0.13O2材料在25 mA·g-1下的初始充、放电曲线[64]
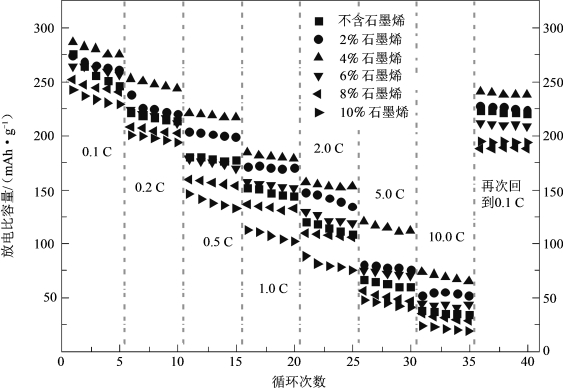
图5-60 具有不同石墨烯添加量的Li1.2Mn0.54Ni0.13Co0.13O2材料在不同倍率下的放电比容量[64]
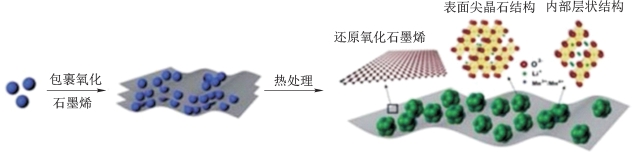
图5-61 石墨烯包裹的层状富锂正极材料[65]
由于Al不与正极材料发生反应,所以采用Al包覆正极材料不仅能够有效地保护材料,而且能够提高材料表面的电子传导率。借鉴Al已经成功地运用于尖晶石锰酸锂(LiMn2O4)的经验,Manthiram等[66]采用气相沉积法制备了不同含Al量的Li[Li0.2Mn0.54Ni0.13Co0.13]O2包覆材料。在低倍率下,Al沉积时间为20 s和30 s的包覆材料在50周后的可逆容量和容量保持率都高于未包覆材料,其中沉积时间为30 s的电极材料容量保持率能够达到98%,可逆容量稳定在280 mAh·g-1,比未包覆的材料高出约50 mAh·g-1;在5 C倍率下,沉积时间为20 s和30 s的包覆材料其放电比容量分别为157 mAh·g-1和143 mAh·g-1,而未包覆的只有93 mAh·g-1。研究表明:包覆层除了能够抑制材料与电解液的副反应,增加表面电子传导外,更重要的是,能够抑制在首次循环后富锂材料中氧空位的消失。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






