阴离子掺杂的元素比阳离子掺杂可供选择的元素少很多,最常见的阴离子掺杂元素是氟元素。一些聚阴离子也被证实可以成功掺入富锂锰基材料中,如PO43-和BOxy-等[9]。在研究初期,研究阴离子掺杂是为了抑制层状富锂锰基材料中氧气的释放以达到提高循环稳定性的目的,同时也可以通过增强富锂材料的动力学因素从而使材料的倍率性能得到提升。关于F元素掺杂改性富锂层状材料的文献相对较多。
Yang等[21]在Li[Li0.2Mn0.54Ni0.13Co0.13]O2中掺入了F元素,通过实验和分析发现,氟掺杂可以稳定电极-电解液界面,减少LiF的生成使阻抗更加稳定。在0.2 C倍率下循环50周,改性后的含F材料的容量保持率为88.1%,而本体材料的容量保持率仅有72.4%。Song等[22]也报道了类似的结果。
Kang等[23]采用溶胶-凝胶法制备了F掺杂的改性层状富锂材料Li[Li0.2Ni0.15+0.5zCo0.10Mn0.55-0.5z]O2-zFz(0≤z≤0.1),并且在制备该化合物时,调节Ni和Mn含量使Ni,Co,Mn的氧化态分别固定为Ni2+,Co3+和Mn4+。
图5-12比较了不同氟掺杂剂含量的Li[Li0.2Ni0.15+0.5zCo0.10Mn0.55-0.5z]O2-zFz材料的放电比容量与循环性能,循环条件为室温2.0~4.6 V。可以看到F掺杂材料虽然首周放电比容量略有降低,但随着氟含量的增加,循环性能大大提高。未掺杂材料40次循环后的容量保持率为79%,而F掺杂材料几乎没有容量衰减。如图5-13所示,在55℃下循环,未掺杂材料循环后比容量显著下降,但氟掺杂材料的循环特性表现优异。此外,他们还发现F掺杂同样可以显著降低材料的阻抗。
还有文献报道了通过F掺杂改善层状富锂锰基材料的首周库仑效率和电压衰减问题。Li等[24]用LiF作为F离子掺杂的原材料,然后通过碳酸盐共沉淀法合成了F掺杂改性的层状富锂正极材料Li1.2-xMn0.54Ni0.13Co0.13O2-xFx。
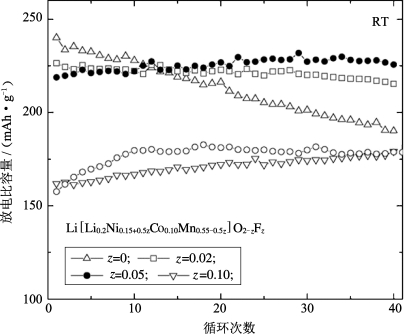
图5-12 室温下在2.0~4.6 V的电压范围内循环的Li/Li[Li0.2Ni0.15+0.5zCo0.10Mn0.55-0.5z]O2-zFz电池的放电比容量[23]
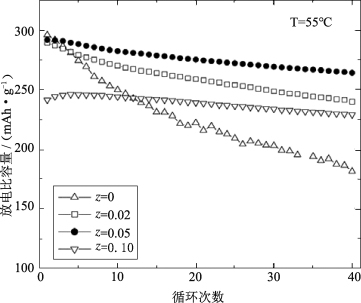
图5-13 Li/Li[Li0.2Ni0.15+0.5zCo0.10Mn0.55-0.5z]O2-zFz电池在55℃,2.0~4.6 V电压范围内的放电比容量与循环次数的关系[23]
对比原始层状富锂材料和F掺杂的富锂材料的SEM图像材料看出,Li1.2-xMn0.54Ni0.13Co0.13O2-xFx掺杂改性材料具有球形形态。直径约为4 μm的大型二次球形颗粒是由圆边的纳米级一次颗粒(直径<100 nm)组成的,这些二次颗粒间有孔隙,可使液体电解质循环进入微米级球体,并在电极材料和电解质之间获得良好的接触[25]。随着F掺杂剂的增加,纳米级一次颗粒的粒径会从50~100nm增长到200~300nm,其形状也从圆边形变为多边形。这可能是因为LiF对结晶的影响,有报道称LiF可作为晶体生长的促进剂,降低烧结温度[26],从而改善较高温度下材料的结晶度。颗粒形态的变化表明氟掺杂可能改变其表面生长动力学。
不同F掺杂量的材料的充电和放电曲线如图5-14所示,从图可以看出,在首周充电过程中,在4.5 V附近出现一个电荷平台,对应晶格的不可逆氧损失,同时伴随着Li +从Li2MnO3组分中的脱出(Li2MnO3 →2Li+ + 2e- + 0.5O2 +MnO2)。从图中还可看出,在第1次循环充电曲线中,随着F掺杂量的增加,4.5 V左右的充电平台在逐渐缩短。这是因为F元素取代了部分氧元素,从而减少了首周不可逆的氧损失,首周的库仑效率有所提升。与此同时,F元素有抑制从层状向尖晶石转化的作用,有助于稳定晶体结构。因此,F掺杂材料在随后的循环中表现出比原始材料更好的结构稳定性。
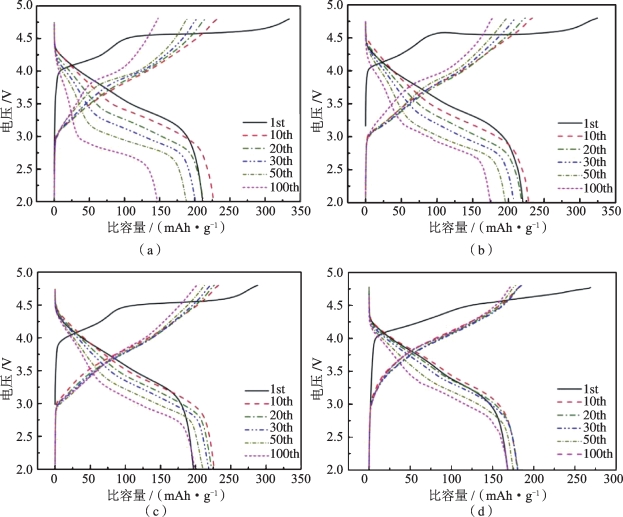
图5-14 Li1.2-xMn0.54Ni0.13Co0.13O2-xFx在0.2 C下的充、放电曲线[24](a)x=0;(b)x=0.02;(c)x=0.05;(d)x=0.08
不同F掺杂量的材料在0.2 C下的循环性能如图5-15所示,在图5-15 中可以观察到,尽管F掺杂降低了原始材料的初始放电比容量,但它显著改善了材料的循环稳定性。F掺杂的三种材料在100次循环后拥有比原始材料更高的放电比容量。与100次循环后的原始材料的容量保持率62%相比,F掺杂材料的容量保持率分别为75%(x=0.02),87%(x=0.05),95%(x=0.08)。这种改进主要归因于F取代O的结构稳定作用,在循环期间延迟了从层状到尖晶石的转变以稳定晶格结构。所以F掺杂材料表现出更高的可逆容量和更稳定的放电电压。(www.daowen.com)
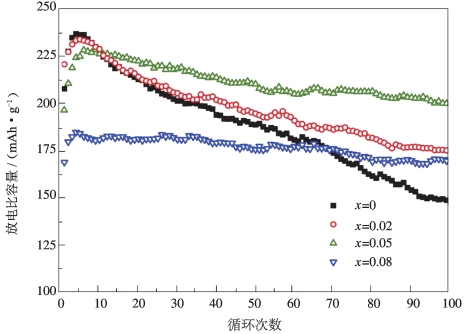
图5-15 Li1.2-xMn0.54Ni0.13Co0.13O2-xFx在0.2 C下的循环性能[24]
但是有部分学者认为在层状富锂材料掺杂氟元素是十分困难的,因为通过核磁共振等测试表明,F更倾向于生成金属氟化物滞留在氧化物表面而非进入晶格内部[27],这个结论也同样适用于层状三元正极材料[28]。也有学者认为F可以进入层状组分晶格,但范围非常小[29],关于阴离子掺杂的机理还有待更深入的研究。
此外,一些聚阴离子也被证实可以成功掺入层状富锂锰基材料中,如PO43-和BOxy-等。聚阴离子型化合物是一类由四面体聚阴离子结构单元(XO4)n-及其衍生物(XmO3m+1)n-(X=B,P,Si,S,As,Mo或 W)与MO(xM为过渡金属)多面体结合的强共价键合的材料。
Xia等学者成功制备出聚阴离子掺杂的层状富锂材料Li[Li0.2Ni0.13Co0.13M0.54](BO4)0.75x(BO3)0.25xO2-3.75x(简写为Bx-LRM,其中x=0,0.02,0.04和0.08)[9]。其电化学性能如图5-16所示。
他们发现,在层状富锂锰基材料中加入聚阴离子(BO3)3-和(BO4)5-对富锂正极材料进行改性后,改性后的富锂正极材料的比容量、循环性能、氧化还原电位和热稳定性明显得到了改善,这主要是由于硼聚阴离子能够促进材料生成更为有序的过渡金属层以及更加完整的层状结构,另外能够使氧离子在高压下更加稳定。
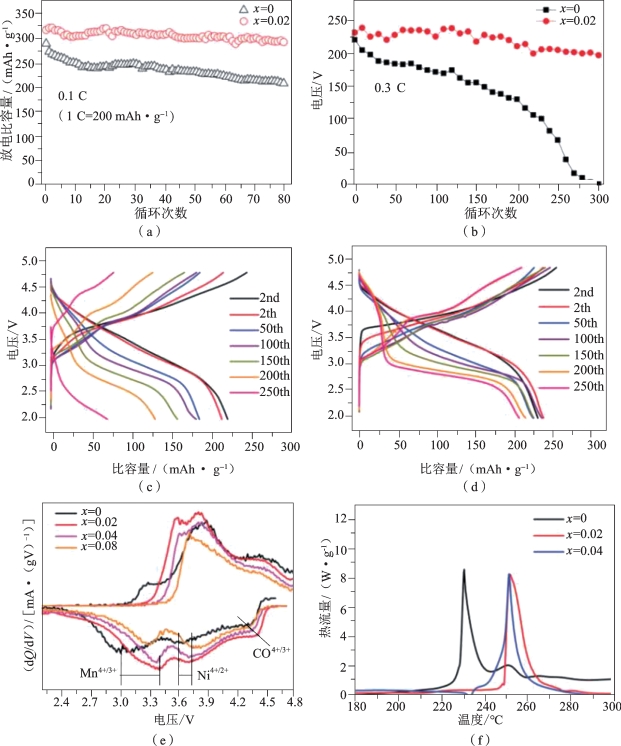
图5-16 Bx-LRM的电化学性能[9]
在(a)20 mA·g-1和(b)60 mA·g-1的电流密度下,x=0和0.02时Bx-LRM的循环性能;电流密度为60 mA·g-1时,(c)x=0和(d)x=0.02的Bx-LRM的电压变化;(e)Bx -LR的第5个循环的dQ/dV曲线,电流密度为60 mA·g-1;(f)在第二次循环时在4.6 V下充电的Bx-LRM的DSC曲线,并以10℃·min-1的扫描速率在恒定电压下保持10 h。所有电池均在室温下测试
从图5-16(a)中可以看出,未掺杂聚阴离子的层状富锂材料(B0-LRM)表现出较差的循环性能和70%的容量保持率,其第一个周期比容量为298 mAh·g-1,在第80个周期下降到210 mAh·g-1。而聚阴离子改性材料B0.02-LRM(x=0.02)具有优异的循环性能,容量保持率可达94%,在第一次循环时比容量为319 mAh·g-1,在第80次循环时约为300 mAh·g-1。但是随着x的增加,材料的初始循环比容量有所下降,当x=0.08时,会降至200 mAh·g-1,但在第80个循环时恢复至约250 mAh·g-1。x=0.08时,初始循环的比容量较低,这是由于Li2MnO3组分的不充分活化。但在随后的循环中,激活过程继续进行,比容量得以增加。图5-16(b)中原始材料B0-LRM表现出大容量衰减,而B0.02-LRM材料在200次循环后容量保持率约为89%,但是由于颗粒的尺寸大于B0-LRM,所以B0.02-LRM的倍率性能没有太大改善。
由图5-16(c)和(d)看出,Bx-LRM材料的电压降低的趋势减弱。在60 mA·g-1的电流密度下循环300次后,B0.02-LRM仍然能保持2.7 V的平均放电电压,而B0-LRM的电压呈现出剧烈的线性下降。图5-16(e)为掺杂改性材料第5个循环的dQ/dV曲线,可以发现在掺入硼之后,对应Mn和Ni的氧化还原峰强均得到增强。因此,与B0-LRM相比,硼掺杂材料B0.02-LRM具有更高的能量密度。Li等通过测试还得知,样品B0.02-LRM在65 ℃下比B0-LRM的稳定性更高。
所以结合聚阴离子(BO3)3-和(BO4)5-可以改善层状正极材料的性能,可知该材料比容量、循环性能、氧化还原电位和热稳定性等性能的明显改善可归因于M—O键的共价性降低和更低的O2p轨道能量。
此外,PO43-掺杂的Li1.17Ni0.20Co0.05Mn0.58O2材料也取得了十分明显的成效,经过100次循环后电池表现出最小的电压衰减率,仅为1.5 mV[30]。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






