阳离子掺杂可选择的元素很多,理论解释也较多,目前已经报道的元素包括Na,Mg,Al,Si,K,Ti,V,Cr,Fe,Zn,Ga,Se,Y,Zr,Nb,Mo,Ru,Sn,La,Nd,Yb等,也有采用Ru,Fe,Co等来取代Ni或Mn元素的报道,有部分文献也报道了用聚阴离子掺杂富锂锰基正极材料,如PO43-,SiO44-和SO42-等[11]。阳离子掺杂后可以明显地提高材料的循环稳定性和倍率性能,这与掺杂阳离子在晶格内部的位点有关,一般有两种情况:如果掺杂阳离子位于锂位,可以起到“支柱”作用,在充、放电过程中大量锂离子脱出的时候保持锂层的稳定,从而提高了材料循环稳定性,同时还能减少锂镍混排,增大锂层与锂层之间的层间距,使得锂离子能够快速地脱出和嵌入,提高倍率性能;如果掺杂阳离子位于过渡金属位,可能会形成更强的金属—氧键,使结构更加稳定。这些都能促进锂离子的传导,对晶体结构的稳定性也有很大帮助。
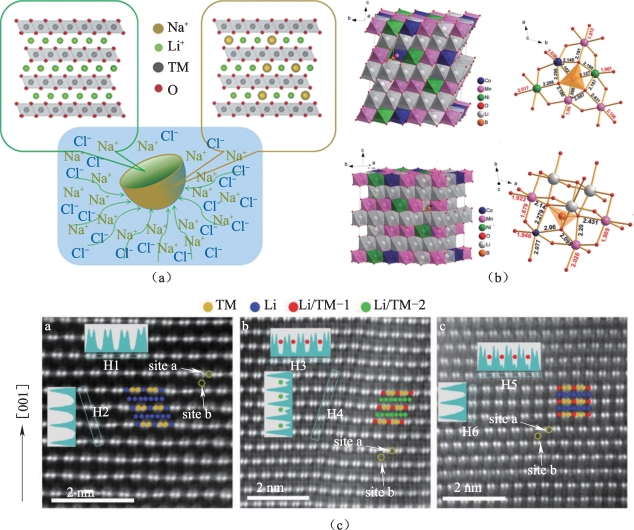
图5-1 富锂锰基材料典型元素掺杂改性示例
(a)钠离子的锂位掺杂[8];(b)硼-氧聚阴离子掺杂[9];(c)硅元素的锂位/过渡金属位混合掺杂和锡元素的过渡金属位掺杂[10]
Nayak等[12]报道Al3+掺杂对Li1.2Ni0.16Mn0.56Co0.08O2材料循环时的比容量和放电电压有显著的稳定作用。他们用Al取代了富锂锰基层状氧化物(LMLO)中的部分Mn元素,并比较了不同Al离子掺杂量对材料比容量和放电电压的影响。结果发现,循环过程中的电压衰减随着掺杂的Al离子量的增加而有所减弱,其比容量也有所提升。他们发现Al3+掺杂对LMLO的结构稳定性具有表面和体积效应:用Al3+代替Mn4+会促进Ni3+形成以用于电荷补偿,而Ni3+比Ni 2+半径小,从而导致晶胞参数减小;在循环过程中形成LiAlO2和AlF3,这些成分能够提高材料表面的锂离子扩散速率。Al掺杂对富锂锰基氧化物层状结构的稳定有两个原理,一是掺杂Al3+后可以抑制阳离子迁移;二是抑制了层状结构向尖晶石结构的转变,而结构从层状向尖晶石的转变被认为是材料比容量和电压衰减的主要原因。
Mg也是常用的掺杂元素。Mg和Al在元素周期表中的位置非常接近,但由于离子半径不同,Mg2+对层状富锂正极材料电化学性能的改善机制不同于Al3+。Al3+掺杂并不影响首次充电期间的析氧平台,但Mg2+掺杂会缩短这一平台,这是因为Mg2+的掺杂导致更强的Mg—O键的形成,抑制了氧阴离子的氧化还原[13]。另外,由于与材料中的其他过渡金属离子相比Mg2+与Li+有更为接近的离子半径,所以过渡金属层中的Mg能够在循环时优先向锂层迁移,抑制其他过渡金属离子(Mn和Ni)迁移,减缓相转变,防止电化学性能恶化;且Mg2+在锂层可以起到支持结构的作用,防止晶胞体积过度收缩或膨胀而导致层状结构塌陷。同时镁掺杂可以提高电极的电子导电性,因此,Mg掺杂对层状富锂材料的倍率性能也有一定的提升。Jin等[14]通过溶胶-凝胶法将Mg元素掺入Li[Li0.2Ni0.13Co0.13Mn0.54]O2三元富锂材料中,XRD测试表明,Mg2+使得层间距增大,加快了Li+在层间的传输,使材料倍率性能有所提升。当Mg2+的掺杂量为2%时,在1 000 mA·g-1的电流密度下放电比容量高达150 mAh·g-1,并且容量保持率较高。
除了比较常见的Al,Mg等元素掺杂,Li等[15]通过草酸盐共沉淀法将大离子半径的三价钇(Y)掺杂到二元富锂锰基材料中作为四价锰的替代元素,其过程如图5-2所示。所谓草酸盐共沉淀法,即使用(NH4)2C2O4(过量5%)溶液与溶于去离子水中的相应的化学计量比的硝酸锰、硝酸镍和硝酸钇混合在一起,使前驱体充分沉淀结晶(该过程中添加氨水以保证溶液的pH维持在7.0左右)。该方法与传统的共沉淀法及溶胶-凝胶法相比,更容易实现阳离子Y3+在富锂层状结构中的掺杂。
反复洗涤、过滤、干燥后,得到相应的前驱体,最后煅烧得到层状富锂锰基材料及其不同Y掺杂量的改性材料Li1.2Mn0.6-xNi0.2YxO2(x=0,0.01,0.03,0.05),分别将掺杂量x=0.01,0.03,0.05的样品命名为YD1,YD2和YD3(YD:yttrium dopped)。
钇元素掺杂形成的Y—O键的结合能比Ni—O键的更高,掺杂后有利于提升材料层状结构的稳定性;此外Y3+的离子半径(0.096 nm)显著大于Mn4+的离子半径(0.053 nm)[16],将Y3+掺入层状结构可以有效扩宽晶格中的锂离子通道,提升材料的倍率性能。
图5-2所示为YD1,YD2,YD3和本体Li1.2Mn0.6Ni0.2O2的XRD图谱。对于掺杂样品YD1,YD2和YD3来说,主峰呈现出与本体材料类似的层状富锂正极材料的特征峰,随着钇元素掺杂量的提升,出现与Y2O3标准峰吻合的肩峰[17]和与LiYO2标准峰吻合的肩峰(图5-2中星号和方形图标标识处)。
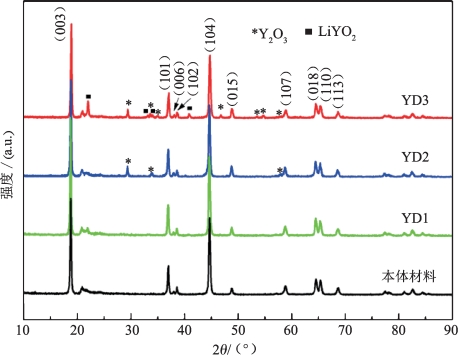
图5-2 YD1,YD2,YD3和本体Li1.2Mn0.6Ni0.2O2的XRD图能谱图[15]
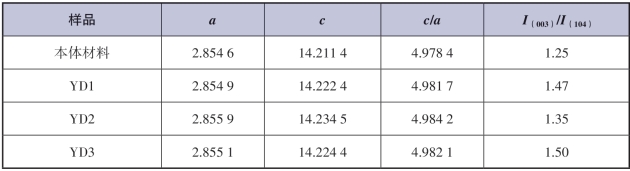
材料的晶胞参数出现变化可以证实掺杂离子已经进入材料晶格。采用最小二乘法计算出所有样品的晶胞参数,如表5-1所示。在层状α-NaFeO2晶格中,晶胞参数a代表金属-金属间距,而晶胞参数c代表晶格中层间距,晶胞参数c/a值可以作为材料的层状特征指数,c/a值越大,材料的层状特征越明显。从表中数据可以明显发现,掺杂后的样品晶胞参数a,c均比本体样品中的大,这表明掺杂后样品的晶格中嵌脱锂通道得到扩展,这可能是Y离子(0.096 nm)取代较小的Mn离子(0.053 nm)所致。但是晶胞参数与钇的掺杂量不成正比,如YD3样品的晶胞参数小于YD2的晶胞参数,这可能是由于钇与氧的结合力更强,当掺杂量增加达到一定程度后,Y与O的强结合力会使层间距出现收缩[16]。同时,掺杂样品比未掺杂的本体样品表现出更好的层状特征。此外,衍射峰峰强比值I(003)/I(104)与层状结构中阳离子混排有关,掺杂后该峰强比值均大于本体材料的,即掺杂后样品的Li+-Ni2+阳离子混排现象有所抑制。
表5-1 YD1,YD2,YD3和本体Li1.2Mn0.6Ni0.2O2的晶胞参数对比表[15]
综上所述,掺杂前后样品晶胞参数的变化证实了Y3+成功掺入富锂层状材料中,Y3+掺入使得材料层状特征更明显,同时锂镍阳离子混排得到有效抑制。如图5-3所示,由于钇的掺入,掺杂改性样品的层状结构更加稳定,且锂离子嵌脱锂通道有所扩展;掺入晶格中的Y元素在材料中主要以Y2O3或LiYO2的形式存在,极有可能保留了层状富锂材料的氧空位,使电解液对材料的溶解和腐蚀得到抑制。
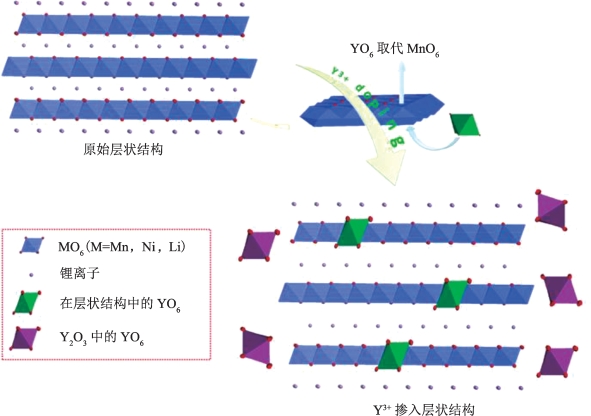
图5-3 层状本体样品与钇掺杂样品晶体结构示意图[15]
材料的首次充、放电性能如图5-4和表5-2所示,图5-4(a)所示为各种样品的在0.1 C下(20 mA·g-1)首次充、放电曲线及对应的微分容量曲线。从首次充、放电曲线中可以看到,所有样品的充、放电曲线形状相似:充电曲线由4.5 V以下的斜坡和4.5 V左右平台,分别对应Ni2+向Ni4+的氧化和Li2MnO3活化;放电曲线为下降的曲线,对应Ni4+向 Ni2+的还原和新衍生的层状MnO2中Mn4+的还原。从表5-2中可以看到,本体材料和YD1样品的首次充电比容量分别为372.3 mAh·g-1和372.1 mAh·g-1,接近材料的充电理论值。但是这两个样品首次不可逆容量较高(均大于100 mAh·g-1),所以首次库仑效率偏低。YD3样品中Y元素的含量最高,材料中Li2MnO3成分的含量较少,该材料的4.5 V平台在所有的样品中最短,它的首次不可逆容量在所有样品中最小,为69.1 mAh·g-1。YD2样品的首次库仑效率(79.0%)和放电比容量(281.0 mAh·g-1)是所有样品中最高的,这可能是由于适量的Y3+掺杂能够稳定材料的层状结构,且掺入的微量Y2O3能够在首次充电时保护氧空位,减少锂空位在材料表面结构转变过程中的消失[18]。相反,少量或不足量的钇掺杂对材料性能改善作用有限;过量的钇掺杂难以进入富锂材料的层状晶格中,从而生成较多杂质使活性成分的含量减少。
图5-4(b)为样品首次循环过程中的微分容量曲线。所有样品均在4.5 V出现两个氧化峰,这两个峰分别对应Ni2+→Ni3+和Ni3+→Ni4+的氧化,4.5 V左右的强氧化峰是晶格中Li+和O以Li2O的净形式电化学脱出过程。钇掺杂样品中,在4.5~3.0 V之间有Ni4+→Ni2+,Mn4+ →Mn3+的还原峰,在4.5 V以上和2.9~2.7 V两个区间也存在还原峰(图中虚线方框),在这区间,层状本体材料并未参与电化学反应。该还原峰的位置与尖晶石结构材料LiNixMn2-xO4的反应位置吻合[19],可能是钇元素的掺入导致主体层状结构产生微量的结构转变。
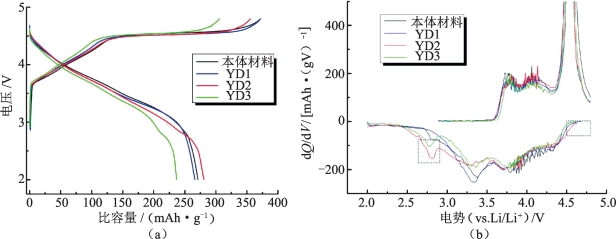
图5-4 YD1,YD2,YD3和本体Li1.2Mn0.6Ni0.2O2的首次充、放电曲线及对应的微分容量曲线[15]
(a)充、放电曲线;(b)微分容量曲线
表5-2 YD1,YD2,YD3和本体Li1.2Mn0.6Ni0.2O2在0.1 C下的首次循环电化学性能[15]
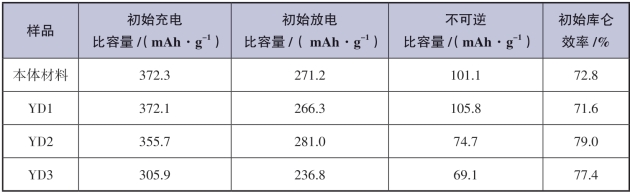
此后,研究人员测试了所有样品的循环性能,如图5-5所示,所有样品的放电比容量均呈现先逐渐降低后趋于稳定的趋势。容量衰减是层状富锂锰基材料晶格中氧空位和锂空位的减少以及高电位循环下电解液对材料的腐蚀的共同作用[18,19]。从图5-5中可以看出,本体材料的首周放电比容量较高,达到271.2 mAh·g-1,但循环40周后比容量衰减量较大,比容量仅为207.5 mAh·g-1,容量保持率仅76.5%。采用钇掺杂对本体材料进行改性后,材料的循环稳定性显著提升,其中YD2样品的容量保持率最高,经过40周循环后比容量可达240.7 mAh·g-1。这是因为钇掺入层状晶格后能在循环过程中稳定晶体结构,而未掺入的微量Y2O3能有效抑制电解液对活性成分的腐蚀和溶解。在所有样品中YD3的容量保持率最高(为90.7%),但是由于活性成分相对减少,循环稳定后的比容量仅为215 mAh·g-1。

图5-5 YD1,YD2,YD3和本体Li1.2Mn0.6Ni0.2O2在0.1 C下的循环特性[15]
倍率性能是锂离子电池正极材料应用于电动汽车和大规模储能的重要考核指标之一。图5-6(a)所示为钇掺杂前后材料的倍率放电图,充电电流为0.1 C,放电电流分别为0.1 C,0.2 C,0.5 C,1 C,2 C,5 C。分析可得:本体材料在小倍率0.1 C和0.2 C时,放电比容量较高,但随着倍率的提升,材料比容量衰减越来越严重,在1 C下容量保持率仅为50%。而对于不同钇元素掺杂量的改性样品,其倍率性能均得到明显提升。样品YD1和YD3在0.2 C~2 C倍率之间的放电比容量较为接近,但YD1样品在5 C时放电比容量更高。YD2样品在各个倍率下均表现出最好的容量保持率,在1 C,2 C,5 C倍率下放电比容量分别达到179.1 mAh·g-1,144.0 mAh·g-1和97.9 mAh·g-1,相比本体材料,在各倍率下容量提升均超过50%。
图5-6(b)为本体材料和YD2材料在各个倍率下的放电曲线。掺入适量钇元素的YD2样品较其他样品表现出更好的倍率性能,这可能是因为适量钇掺入使得层状结构更为稳定,并提供了更宽阔的锂离子通道,从而实现锂离子的快速迁移。
同时Li等还对材料的倍率循环性能进行了表征,本体材料和YD2材料首周放电比容量分别为184.9 mAh·g-1和193.0 mAh·g-1,相差不大。但是在40周循环后YD2样品的容量保持率为95.6%,而本体材料仅为68.6%。本体材料较差的倍率循环性能可能是材料的锂离子导电率较低和表面结构脆弱造成的。所以钇掺杂可以稳定层状结构,拓宽晶格中锂离子通道,而未掺杂的钇元素无论在多高的电流密度下都能以Y2O3的形式保护活性材料,使其免受电解液的溶解和腐蚀。
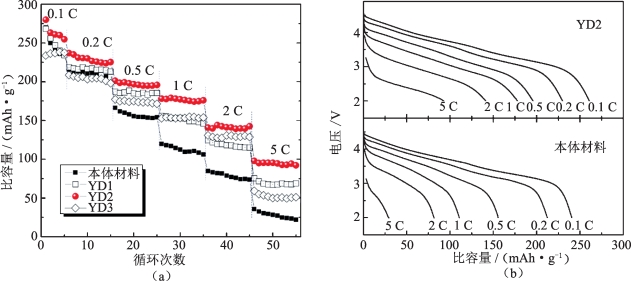
图5-6 YD1,YD2,YD3和本体Li1.2Mn0.6Ni0.2O2的倍率性能图[15]
(a)不同倍率下的放电比容量;(b)不同倍率下的放电曲线
阻抗可以更好地解释材料在钇掺杂前后倍率性能改善的原因,本体材料和样品的电化学阻抗图谱如图5-7所示,图5-7(b)中还对YD2样品的阻抗图进行了等效电路拟合,对应的阻抗数值如表5-3所示,分析可得,所有样品欧姆阻抗都比较小,SEI膜阻抗(RSEI)和电荷传递阻抗(Rct)在钇掺杂过后均出现明显降低。因此,材料倍率性能和循环性能的改善可以归因于锂离子在SEI膜中扩散能力和电化学反应活性的提升。(https://www.daowen.com)
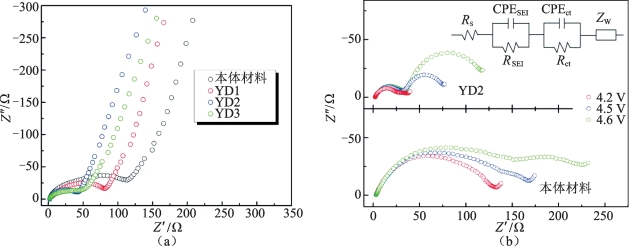
图5-7 本体材料和样品的电化学阻抗图谱[15]
(a)活化前;(b)不同充电状态
表5-3 本体材料和YD2样品不同状态下的阻抗数据[15]

综上所述,Li等采用草酸盐共沉淀法成功实现了钇元素对富锂层状结构的掺杂。各种结果表明:
(1)适量钇元素的掺杂能显著改善材料的比容量、首周库仑效率、循环性能、倍率性能;
(2)超大离子半径的Y3+取代了层状晶格中离子半径较小的Mn4+,扩展了层状结构中锂离子扩散通道,达到锂离子快速迁移的目的,且较强的Y—O键使材料的层状结构更加稳定;
(3)微量未掺入层状结构的钇元素会以Y2O3的形式存在于材料中,有效地保留了层状晶格中的锂空位和氧空位,抑制电解液对主体材料的腐蚀和溶解;
(4)钇掺杂可以有效提升锂在层状富锂锰基材料表面SEI膜中的扩散,降低材料表面的电荷传递阻抗。
Yang等[20]通过溶胶-凝胶法合成了一系列Yb掺杂的富锂锰基正极材料Li1.2Mn0.54Ni0.13Co0.13-xYbxO2(x=0,0.001,0.003,0.005,0.010,0.015,0.020和0.050),分别命名为Yb00,Yb01,Yb03,Yb05,Yb10,Yb15,Yb20和Yb50。Yb掺杂改性材料的电化学性能测试结果如图5-8所示。当Yb掺杂量小于0.005时,与原始材料相比,改性材料的初始放电比容量增加,Yb03样品增加的最多,达到294.5 mAh·g-1,而原始材料仅有260.4 mAh·g-1。该结果证明适度的Yb掺杂对材料初始比容量具有积极影响。相反,随着掺杂量的进一步增加(x > 0.005),材料放电比容量逐渐降低。Yb50(x=0.050)的初始放电比容量最低,只有220.6 mAh·g-1。图5-8(b)、(c)所示为所有样品在0.2 C和1 C下的循环性能。在低掺杂水平下,Yb掺杂后放电比容量和循环稳定性得到改善,但随着掺杂量的逐渐增加,电化学性能显著降低。且可以发现Yb03材料具有最佳的放电比容量,在0.2 C和1 C时分别达到250.3 mAh·g-1和219.8 mAh·g-1,远高于Yb00和Yb50。

图5-8 Yb掺杂的原始材料与改性材料的电化学性能[20]
(a)初始充、放电曲线;(b)0.2 C下循环性能;(c)1 C下循环性能;(d)不同倍率下的循环性能

图5-9 富锂锰基正极材料的Nyquist图及在某些周期的转移阻抗直方图[20]
(a)Yb00,Yb01,Yb03,Yb05,Yb10,Yb15,Yb20和Yb50初始充电前的Nyquist图;(b)Yb00,Yb01,Yb03,Yb05,Yb10,Yb15,Yb20和Yb50第10次充电/放电后的Nyquist图;(c)Yb00,Yb01,Yb03,Yb05,Yb10,Yb15,Yb20和Yb50第50次充电/放电后的Nyquist图;(d)Yb00,Yb03和Yb50在某些周期的转移阻抗直方图
此外,Yb03还表现出优异的循环稳定性,在0.2 C下循环50次和在1 C下循环100次后,容量保持率分别达到87.3%和84.4%。进行多倍率循环测试以进一步检查其倍率性能[图5-9(d)]。同样,Yb03材料在5 C时保持157.2 mAh·g-1的最高比容量。而Yb00和Yb50材料仅为139 mAh·g-1和120 mAh·g-1。此外,当充电或放电倍率从5 C恢复到0.2 C时,Yb03可以保持228.8 mAh·g-1的比容量,而Yb00和Yb50分别为206.8 mAh·g-1和176.2 mAh·g-1。所以,适当的掺杂量Yb(x≤0.005)可以产生优异的电化学性能,过量的掺杂剂量(x>0.005)会导致材料电化学性能的急剧恶化。
图5-9所示为富锂锰基正极材料原始材料和改性材料的电化学阻抗图谱。从图中看出,Yb03在50个循环内的阻抗差值(DR)最小,而原始材料的阻抗差值是中等的,Yb50的阻抗差值变化最大,达到298.35 Ω。这一趋势与上面所示的电化学性能很好地吻合,过量的Yb掺杂能显著增加电荷转移阻抗。
Yang等为了探究Yb掺杂量造成材料电化学性质变化的内在原因,采用了XRD,XPS,ICP和HRTEM等来表征材料的物理和化学特性。通过ICP-AES检测(表5-4)显示,改性材料中过渡金属和掺杂剂的精确含量与目标化学计量具有极好的一致性。从材料的XRD图谱(图5-10)得知,Yb离子已经成功掺杂到所有材料中。接着对Yb03和Yb50样品进行了Rietveld精修(图5-11和表5-5),结果发现,由于掺杂Yb离子的半径大于过渡金属M(Mn,Co和Ni)离子的半径,所以掺杂材料(包括a和c)的主晶格参数均高于Yb00,这表明进入晶格结构的Yb离子扩大了层间距。此外,Li位点处Ni离子占据的减少证实了掺杂材料的Li/Ni混合的减少。原始Yb00不含Yb离子,而掺杂的Yb03在M位点显示Yb离子,占有率为0.27%。较高Yb掺杂的Yb50中的Yb离子不仅占据M位,而且还出现在Li位置。但Yb离子仍然主要停留在M位点。除了更高的Yb离子占有率之外,Yb50材料还表现出明显的Yb2O3相结构,而该结构在Yb00和Yb03中均未出现。
表5-4 ICP-AES检测的原始和掺杂材料的元素组成[20]
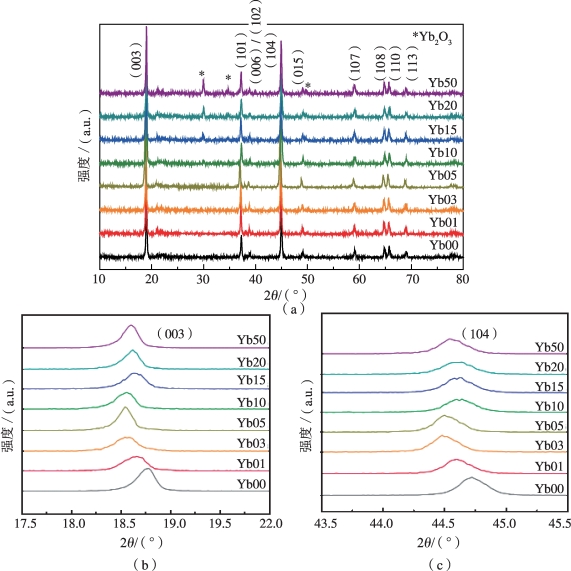
图5-10 材料的XRD图谱[20]
(a)所有材料的XRD谱图;(b)(003)特征峰细节;(c)(104)特征峰细节
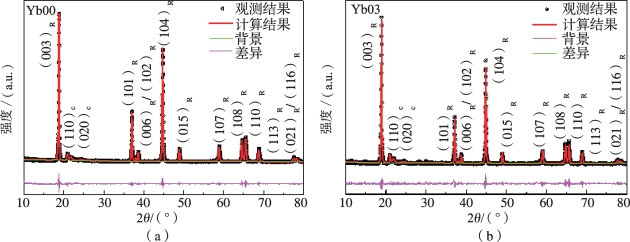
图5-11 Yb00,Yb03和Yb50的精修XRD图谱及所有材料的Yb2O3特征峰[20]
(“R”表示“R3m相”,“C”表示“C2/m相”,Yb2O3特征峰标有“”)(a)Yb00的精修XRD图谱;(b)Yb03的精修XRD图谱
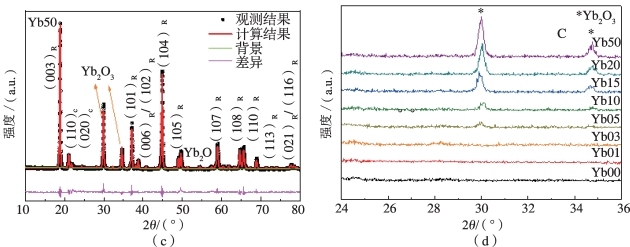
图5-11 Yb00,Yb03和Yb50的精修XRD图谱及所有材料的Yb2O3特征峰[20](续)
(“R”表示“R3m相”,“C”表示“C2/m相”,Yb2O3特征峰标有“”)(c)Yb50的精修XRD图谱;(d)所有材料的Yb2O3特征峰
表5-5 Yb00,Yb03和Yb50的精修结果[20]
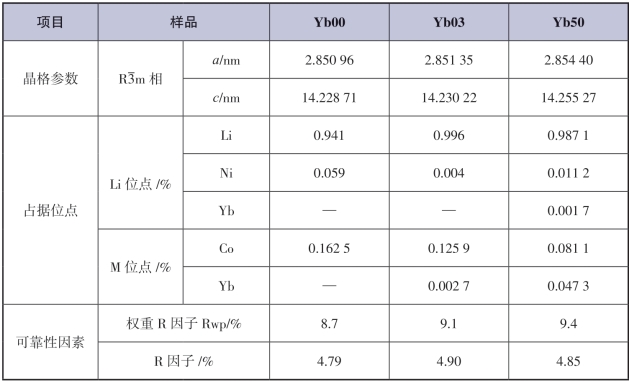
所有结果表明,掺杂适量Yb(x≤0.005)的改性材料具有较高的初始放电比容量,倍率性能和循环稳定性也得到改善。当使用适当的掺杂量(x≤0.005)时,Yb离子将占据M位,由于Yb的较大离子半径和Yb—O较强的结合能,锂层的间距得以扩大且氧骨架也更稳定,允许更快的Li+ 输送而不损害层状结构。
此外,Yb作为多价元素可参与电化学反应,并有助于提高比容量。然而,由于主体材料中掺杂元素Yb和过渡金属元素之间的离子半径差异很大,掺杂剂量被限制在上限(x=0.005)以下。当Yb过量(x>0.005)时,过量的Yb离子倾向于占据Li层,甚至偏析在材料表面上以形成电化学惰性的Yb2O3氧化物,从而阻碍Li+传输并导致电化学性能劣化。这项工作的发现可以为稀土元素在层状富锂正极材料中的应用提供指导和启发。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







