恒电流充、放电是在电流一定的情况下对电池进行充、放电,并记录电池的电压变化情况来得到电池的电化学性能,主要用于测试电池的循环性能以及容量,并可以得到电池容量随充、放电循环产生衰减的数据,通过作出充、放电曲线和容量曲线以反映循环中电池的库仑效率,充、放电和电压平台等数据。
在对电池进行恒流充、放电测试之前,需要计算活性材料理论比容量,即单位质量的活性材料在放电过程中理论上所放出的电量,其计算公式如下:

式中 C0——活性材料的理论比容量,mAh·g-1;
NA——阿弗加德罗常数,mol-1;
e——一个电荷所带的电量(C即As);
z——活性材料氧化还原反应得失的电子数;
MW——活性材料的分子量。
将1 s=1/3 600 h,NA、e等常数代入式(4-2),即可得到理论比容量的计算公式:

由于比容量常用单位为mAh·g-1。因此,式(4-3)转化为:(https://www.daowen.com)
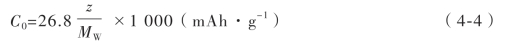
实际放电比容量(C)即单位质量的活性材料在放电过程中实际上所放出的电量,其计算公式如下:
![]()
式中 C——活性材料的实际放电比容量,mAh·g-1;
I——恒流放电电流,mA;
t——放电时间,h;
m——活性材料的质量,g。
典型富锂锰基材料的首次充、放电曲线如图4-9所示,从图中可以人为将材料首次充电曲线分为两个阶段[92]:第一个阶段是充电电压低于4.5 V的斜坡阶段,此时材料中的锂从锂层脱出,伴随如Ni,Co等易变价过渡金属元素的氧化,主要对应结构中R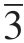 m相的活化,这一阶段的充电比容量可达120 mAh·g-1以上。第二个阶段是充电电压高于4.5 V时的情况,从图中可以看到一个很长的平台,对应的是Li2MnO3组分的活化,平台至4.8 V之间的比容量可超过200 mAh·g-1,这个阶段材料中的Li从过渡金属层中脱出,但此时材料中的过渡金属元素均处于很高的价态,很难继续氧化至更高的价态,因此,有学者提出氧阴离子-过氧/超氧阴离子(O2-/O22-(O2-))氧化还原电对的概念来解释富锂锰基材料异常的高比容量[93-95]。
m相的活化,这一阶段的充电比容量可达120 mAh·g-1以上。第二个阶段是充电电压高于4.5 V时的情况,从图中可以看到一个很长的平台,对应的是Li2MnO3组分的活化,平台至4.8 V之间的比容量可超过200 mAh·g-1,这个阶段材料中的Li从过渡金属层中脱出,但此时材料中的过渡金属元素均处于很高的价态,很难继续氧化至更高的价态,因此,有学者提出氧阴离子-过氧/超氧阴离子(O2-/O22-(O2-))氧化还原电对的概念来解释富锂锰基材料异常的高比容量[93-95]。
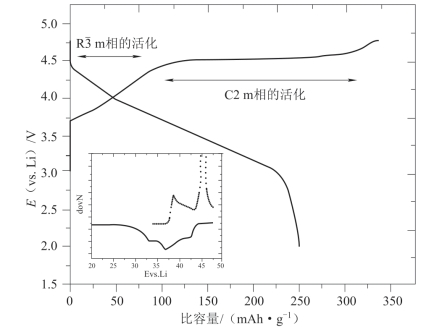
图4-9 Li/0.3Li2MnO3·0.7LiMn0.5Ni0.5O2扣式电池首次充、放电曲线(2.0~5.0 V)[91]
目前对富锂锰基材料电化学循环测试的电压范围基本设定在2.0~4.6 V或4.8 V,在这个电压区间内富锂锰基材料能充分发挥其容量优势。如果缩小电压范围,虽然从理论上来讲任何材料的比容量都将降低,但这一点对于富锂锰基材料来说会更加严重:当材料在3~4.4 V循环时其比容量难以超过170 mAh·g-1,而在2~4.8 V区间内则可以达到250 mAh·g-1左右[96,97]。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







