1.首次库仑效率较低
正极材料的首次库仑效率和首次容量的损失对其实际应用的影响很大。尽管富锂材料首次循环具有很高的比容量,但其首次充电平台处的电化学反应是不可逆的,首次充、放电会产生较大的容量损失,其对应的首次效率小于79.5%。对于富锂正极材料首次容量损失的原因,主要有以下两种解释[45,73]。
一个原因是首次充电至4.5 V平台后,Li2MnO3相的激活会在脱锂的过程中伴随着材料内氧气的释放,导致材料中的部分锂离子不能可逆地嵌入,从而使得首次充放电产生很大的不可逆容量损失。这在富锂材料的充电曲线和循环伏安曲线上都有明显表现。图3-6所示为Li1.2 Mn0.6Ni0.2O2材料(图中LLR样品)及其改性样品(LPLR)在不同循环次数的充、放电曲线。可以看出,无论是本体材料还是其改性材料,首次循环的4.5 V特征平台在后续循环过程中都会消失。图3-7所示是Li1.2Ni0.2Mn0.6O2材料在0.1 mV·s-1扫速下的循环伏安曲线。在首次充电过程中,3.75 V与4.2 V左右的氧化峰分别对应Ni2+/3+与Ni3+/4+的氧化反应。在4.5 V左右出现的巨大氧化峰对应Li+脱出并伴随氧释放,其在随后的循环过程中不再出现,也印证了这一过程的不可逆性[74]。也有学者[75]通过氧同位素标记的方法发现,富锂锰基材料在首次充电至4.5 V时,释放的不是氧气而是二氧化碳,其中有部分氧来自材料晶格,当电压继续升高后,才会有氧气从晶格内部释放,也证实了气体中的氧元素来自材料本身。
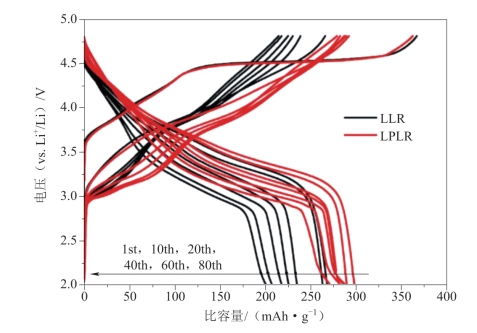
图3-6 Li1.2 Mn0.6Ni0.2O2材料(图中LLR样品)不同循环次数的充、放电曲线[76]

图3-7 Li1.2Ni0.2Mn0.6O2在0.1 mV·s-1扫速下的循环伏安图[77]
另一原因是在较高的截止电压下活化时,正极材料和电解液反应发生不可逆副反应。目前广泛使用的商品化电解液使用范围多为4.4 V以下,高压电解液多为4.5 V以下。而层状富锂材料的首次需充电至4.6 V甚至4.8 V后才能发挥其高比容量效果。因此,电解液容易受到局部过氧化的活性基团的攻击而分解[78],这部分能量将直接体现在材料的充电比容量之中,同时还会在材料表面产生有机/无机物质共生的界面[79-82]。
综上,富锂锰基材料在首周充、放电过程中较低的库仑效率与产气特征使得材料难以实际应用,其商品化进程受到严重阻碍。
2.电压衰减问题
循环过程中电压衰减的问题是目前富锂材料产业化进程中遇到的最大挑战,因为它不仅会导致循环过程中能量密度不断减少,而且会使得电池难以和电池管理系统(BMS)相适配,这是富锂材料实际应用最亟待解决的问题。
层状富锂材料在2.0~4.6 V或4.8 V的循环测试区间能充分发挥其高比容量的优势,但会出现容量和电压衰减严重的情况。其中,在循环过程中富锂材料出现的层状结构向尖晶石结构和无序岩盐结构的转变和极化[83]被认为是引起容量和电压平台衰减的主要原因。
对比循环前后的富锂材料XRD谱图和TEM照片,可观察到这种结构转变的发生。图3-8所示是Li1.2Mn0.6Ni0.2O2在不同循环周数的非原位XRD图。图中(003)和(104)峰在循环后峰强变得十分微弱,其峰位也向右发生偏移,这表明材料的层状结构特征变弱,并伴随层间距的减小;层间距的减小意味着层状结构发生了塌陷,印证了层状特征的减弱[84]。

图3-8 Li1.2Mn0.6Ni0.2O2的不同循环次数后富锂材料的非原位XRD图[84]
图3-9所示为富锂材料循环前的HRTEM图像[84],可以看出富锂完整的层状结构,图像中清晰的0.475 nm的层间距对应典型的层状结构中的(003)峰的层间距;插图中对应的SAED图像亦展示了典型的层状结构特征[85]。

图3-9 Li1.2Mn0.6Ni0.2O2循环前后富锂材料的TEM图像[84]

图3-10 在3.0~4.8 V条件下,LiNi0.5Co0.2Mn0.3O2循环50次后表面区域的HRTEM图像和晶格的FFT图像,其中(b)~(e)分别对应于区域1~4的FFT[86]
在经过电化学循环之后,富锂材料的结构发生了明显的转变,图3-10所示是在4.8 V截止电压下富锂材料典型的结构变化。图3-10(a)所示是循环后富锂材料表层的晶格图像,图3-10 (a)中的1~4四个区域分别对应图3-10(b)、(c)、(d)、(e)四张图。从3-10 (a)图中可以看出体相区域仍然是层状结构[图3-10 (b)],结构变化主要集中在表面区域。在距表面12~15 nm区域出现了连续的尖晶石相[图3-10(c)],在距表面2~3 nm很窄的区域出现了立方相[图3-10(d)、(e)],在图3-10(d)、(e)快速傅里叶变换(FFT)图中,只检测到两个强衍射点,衍射点数量的减少表明高对称岩盐相的形成。由晶格图像和FFT获得的岩盐相间距约为2.45 Å,与NiO(2.42 Å)和CoO(2.46 Å)岩盐相的(11-1)面相符合。从NiO(2.42 Å)和CoO(2.46 Å)之间的晶格参数(2.45 Å)来看,推测它很可能是NiO和CoO之间的固溶体[86]。
Gu等[87-89]提出了过渡金属离子迁移理论来解释富锂材料在循环过程中出现的相变问题。富锂材料在充电过程中可脱出比其他传统层状材料更多的锂离子,因而能够产生更多的锂空位,过渡金属层的金属离子从八面体位置向层间的四面体位置迁移。电压继续升高,会有更多的锂离子从过渡金属层中脱出,过渡金属离子将继续迁移至锂层中的八面体位置。在放电过程中,锂离子嵌入,部分过渡金属回到过渡金属层,部分将会留在锂层的八面体位置。当留下的过渡金属离子较少时,会形成类似于尖晶石的结构,当大量的锂层八面体位置被过渡金属离子占据时,会形成岩盐相结构。这一迁移过程如图3-11所示。这种相变是由表面逐渐向内部发展,从层状结构逐渐向尖晶石和岩盐相转变,在这一过程中还会伴随颗粒的开裂现象,从而导致富锂材料出现循环过程中较严重的容量和电压衰减问题。
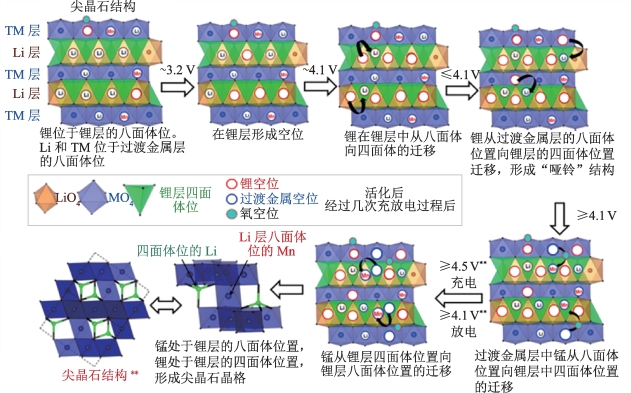
图3-11 富锂锰基材料过渡金属离子迁移导致结构转变机理示意图[88]
此外,组分Li2MnO3晶相由于Li2O的脱出与组分LiMO2晶相形成间隙。这些材料结构上的变化被认为是材料在后续循环过程中结构转变的主要原因。阿贡实验室的研究表明,即使在4.5 V的活化平台下循环,压降现象仍然存在,这一现象是由于晶体中局部尖晶石结构累积造成的。这些尖晶石域,部分是在合成过程中由于Li的损失形成的,存在于材料的表相;部分是在循环过程中由于LiMO2组分中过渡金属离子向Li层迁移导致的。压降的速率主要由两种因素共同决定:层状与尖晶石相的相平衡,以及过渡金属离子的迁移速率。
组分Li2MnO3活化是层状富锂锰基材料具有高容量的根源,但也是产生压降的起因,如何稳定Li2MnO3活化后的衍生物是现阶段解决压降问题的出发点。
近年来的研究表明离子掺杂能有效缓解压降现象。美国东北大学Ates等[90]对0.3Li2MnO3·0.7LiMn0.33Ni0.33Co0.33O2进行了钠离子掺杂,合成了0.3Li2MnO3·0.7Li0.97Na0.03Mn0.33Ni0.33Co0.33O2(掺杂量为5%),掺杂后的材料压降得到了抑制。XRD数据表明,掺杂钠离子后的材料具有更大的晶胞参数,这一变化使得富锂相活化后,Ni3+更易向锂层中的钠空位迁移,这一过程反而使得结构变得更加稳定,抑制了层状相向尖晶石相的转变。中科院福建研究所Li等[91]对Li1.163Mn0.56Co0.140Ni0.138O2进行K+掺杂后合成了Li1.151K0.013Mn0.552Co0.146Ni0.145O2,如图3-12所示。他们认为,锂层中的钾离子弱化了锂层空位的形成与Mn向其中的迁移,此外,K+较大的离子半径,也对尖晶石相的生成造成了很大的空间位阻,由此降低压降的程度。以上研究表明,离子掺杂,尤其是大离子半径的元素,对富锂材料的压降有一定的抑制作用。
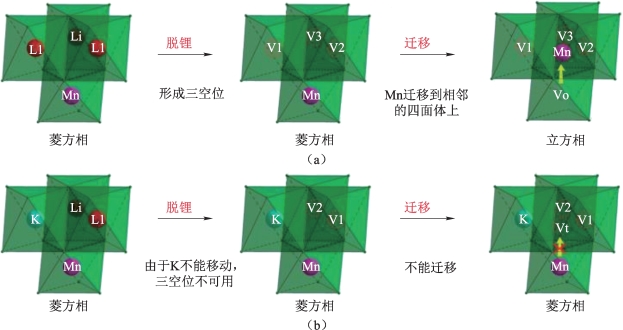
图3-12 K+掺杂层状富锂材料[91](https://www.daowen.com)
阿贡实验室Belharouak等通过Al2O3的原子层沉积技术(atomic-layer deposition,ALD)在材料的表面包覆了一层Al2O3,使压降问题得到改善[92]。然而,这一方法并未真正解决压降与电压滞后的问题。这一研究表明,体相形成尖晶石相是压降的主要成因,因此表面包覆是无法真正解决这一问题的。这一观点在其他研究中并未得到证实。如北京理工大学李宁等[93]通过仿生设计,在富锂材料表面包覆了超薄的尖晶石膜,由于结构转变,改性前后材料均表现出压降现象,但改性后材料在经过一段时间循环后,压降现象得到显著抑制。
西北太平洋国家实验室Wang Chongmin等[94]通过原子序数衬度成像及XEDS谱图研究发现,合成方法极大影响了元素在材料水平空间中的分布情况,尤其是Ni元素的偏析现象,如图3-13所示,使得富锂材料的压降现象更为严重。该研究表明,通过共沉淀法与溶胶凝胶法制备的富锂材料Li1.2Ni0.2Mn0.6O2,表面富集了较多的镍;而采用溶剂热法合成的材料,元素分布较为均匀,其压降也得到了很好的抑制。同时,循环过程中本征结构变化带来的缺陷也会加速诱导镍的不均匀分布。镍元素分布不均的材料,主要由R3m相主导,偏析的镍阻碍了锂离子的脱嵌,并降低了与锰之间的相互作用,使得锰更容易发生还原反应,导致压降;而镍元素分布均匀的材料,主要由C2/m型单斜晶系主导,其更稳定的结构有助于抑制过量锂的脱出与氧流失。

图3-13 不同合成方法制备的富锂材料中的元素分布[95]
有趣的是,湘潭大学的王先友等通过一种浓度梯度的设计来抑制Li1.14[Mn0.60Ni0.25Co0.15]0.86O2压降[95]。如图3-14所示,该富锂微球中,由内部往表面的方向,锰元素的含量逐渐增加,而钴逐渐减少,镍基本维持不变。作者认为富钴区域对压降起到了抑制作用。
如前文所述,组分Li2MnO3活化是层状富锂锰基材料具有高容量的根源,但也是产生压降的起因,得克萨斯大学奥斯汀分校的Manthiram等[96]认为,首周活化过程中4.5 V充电平台的长短决定了压降的程度,并以此设计了一种新的富锂材料:Li1.2-xMn0.54Ni0.13+2xCo0.13-xO2,最优为Li1.15Mn0.54Ni0.23Co0.08O2,与Li1.2Mn0.54Ni0.13Co0.13O2相比,压降得到了抑制。阿贡实验室的Croy等[97]也认为,富锂材料的电压滞后现象与压降现象被证明是相互关联的,均是由富锂相的首周活化引起的。锂离子和锰离子在其中的排布,对于该类材料的压降行为有着至关重要的作用,其作用机理还需进一步深入研究。减少Li2MnO3的相对含量,降低其活化程度,增大Mn/Ni间的相互作用,降低Mn/Mn间的相互作用,可能是一种抑制压降的可行思路。

图3-14 元素浓度梯度分布的层状富锂材料[95]
Thackeray小组的另一项研究是以Li2MnO3为模板,通过酸处理,将化学计量比的Li2MnO3与适量过渡金属元素混合在一起,然后进行煅烧,设计了一系列“层-层”“层-尖晶石”“层-尖晶石-岩盐”复合材料,如图3-15所示[98]。这一方法有效抑制了材料的压降。

图3-15 不同构成成分的层状富锂材料[98]
3.电压滞后问题
富锂锰基材料在电化学循环时存在电压滞后的现象[99-103]。如图3-16(a)所示,在充放电循环过程中,放电电压曲线远低于充电电压曲线,导致电池体系能够释放的能量远低于充电时消耗的能量,使得以富锂材料为电极的锂离子电池能量效率较差。富锂锰基材料的电压衰退和电压滞后之间存在着一定的关联,造成两个现象的共同原因可能是过渡金属离子可逆迁移引起充、放电路径和结构的不对称,这种离子迁移与不可逆相变与锰原子的尺寸及电子自旋排布的特点有关[104]。此外,通过硬X射线光电子能谱(HAXPES)和X光吸收光谱(XAS)与电化学表征手段将阴离子氧化还原与电压滞后相联系起来[图3-16(b)],并发现,相比于快速的阳离子氧化还原过程,在高电压下的阴离子氧化还原受迟缓的动力学限制。因此,电压滞后和迟滞的动力学累积会造成富锂材料总体的极化变大[69]。

图3-16 富锂锰基材料电化学性能[69]
(a)第五周循环电压-比容量曲线以及能量效率;(b)微分容量曲线-电压滞后和电压衰减关系示意图
电压滞后现象一般与材料的反应动力学密切相关,这在LiMnO2等材料中较为常见,通过提高电化学反应时的外界温度可以有效缓解这一现象,但Ohzuku等[105]的研究表明,富锂锰基材料的电压滞后不会随外界温度上升而减弱,反而增强;Thackeray等学者通过原位XRD发现,材料的晶胞体积变化并不存在“滞后”的现象[106]。通过非原位XRD的结果发现,晶胞体积在放电过程中存在滞后现象,通过XAS发现,Mn元素所处位置在材料活化后基本没有变化,Co元素和Ni元素在充、放电过程发生了变化明显。因此可以推测出:电压滞后现象与过渡金属离子在过渡金属层和锂层之间随着充放电的迁移有关,这个往复迁移的特点与电压衰减问题有关,但也不完全相同。
除此之外,另一种观点认为,电压滞后是由于材料中阴阳离子参与电荷补偿时存在先后顺序[69,107,108]。当充电至4.1 V及以上时,其结果如图3-17(a)、(b)所示。这部分的放电曲线无法随着不同充电电压而重合,从而产生滞后现象。结合不同氧化还原电对容量贡献的区间可知:红色部分对应的是Mn和O的电对,尤其是在高电压部分主要由氧阴离子参与氧化还原反应,而这部分的电压滞后现象最为明显。同样的结论也可从图3-17(c)、(d)中得到。

图3-17 富锂锰基材料电化学性能[107]
(a)不同充电截止电压下的电压-比容量曲线;(b)不同放电截止电压下的电压-比容量曲线;(c)不同充电截止电压下的微分容量曲线;(d)不同放电截止电压下的微分容量曲线
4.较差的电化学反应动力学
富锂材料中Li2MnO3相及其活化后的Li-Mn-O组分参与电荷补偿速率明显比层状LiMO2更慢,由此产生了反应动力学阻滞的情况,影响了富锂材料的倍率性能和低温性能。针对富锂材料较差的反应动力学问题,众多学者进行了相关研究。
首先,Yu等通过原位XAS和XRD等手段发现了Li2MnO3相是影响富锂材料反应动力学的关键因素[99]。通过将不同结构成分和过渡金属元素所产生的容量贡献与局部结构变化联系起来,发现在活化前后Mn的反应动力学都比较差,并提出Li2MnO3组分是影响富锂锰基材料的倍率性能的关键因素。Zhang等发现在大倍率充、放电情况下的富锂材料反应动力学阻滞更明显[100]。此外,充、放电时的温度对动力学阻滞的影响也十分明显[103,109]。首先,富锂锰基材料的首次活化对温度敏感,通过进一步研究发现Li2MnO3组分的活化与转变对温度敏感[111]。当温度为-20℃时,富锂材料在首次充电至4.8 V时没有出现明显的4.5 V特征平台,且首次放电比容量仅有70 mAh·g-1左右。其次,Qiu等[111]发现升高温度能够有效提高锂锰基材料的首周库仑效率。升高温度提高了嵌入MnO2组分的动力,将首次库仑效率由74.6%(0℃)提高至91.5%(50℃)。关于富锂材料反应动力学机理和改性的研究仍然较为缺乏,改善富锂锰基材料的反应动力学,能够有效提高材料的倍率性能和高低温性能,提升其实际应用价值。
5.层状富锂电极与电解液间的副反应
从前面的论述中可以看出,为了充分发挥层状富锂正极材料的高容量优势,在充电时截止电压必须大于或等于4.6 V。但是在高电压条件下,正极中的活性物质会与电解液发生大量的副反应,连续副反应机理示意图如图3-18所示。

图3-18 层状富锂正极材料在密闭系统中氧参与的连续副反应机理示意图[82]
比如,在首次充电时,除了失去两个电子生成副产物氧气外,更容易发生只失去一个电子产生氧基,氧基与碳酸基电解液会发生副反应生成H2O、CO和CO2等副产物。副产物水与LiPF6反应会生成LiF,HF等。而HF会加速过渡金属离子溶出,迁移到负极而被还原。LiF不仅消耗了锂源,降低了材料的放电比容量,还降低了电极表面的导电性,造成材料的倍率性能下降。此外,氧基还与副反应产物CO2反应生成过氧碳酸根离子,过氧碳酸根离子在放电时与Li结合生成Li2CO3和氧气。产生的Li2CO3在充电到4 V以上时会被电化学分解,可以贡献部分容量。在放电时虽然又有部分Li2CO3生成,但经过循环充、放电后终将被消耗。与此同时,副反应产物的不断累积会在活性材料表面生成一层厚的SEI膜,从而影响电极反应动力学,电解液不断被消耗,最终造成其性能的快速下降[112]。因此,提高富锂材料的表面稳定性是十分必要的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





