典型的富锂材料首次充、放电曲线如图3-3所示。可以将曲线分为两个部分:第一部分是在首次充电时电压低于4.5 V(vs.Li+/Li)的区间,出现一段沿斜线上升的曲线,主要对应结构中R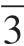 m相的活化,此时富锂材料中组分LiMO2中的Li+从锂层脱出进入电解液,迁移至负极,并伴随着过渡金属Ni2+氧化成Ni4+(三元富锂材料中还包括Co3+氧化成Co4+)[8],遵循传统层状嵌脱锂材料的机理,即LiMO2→Li++MO2+e-,并且在反应过程中Li2MnO3中锰层中位于八面体位置的Li+扩散至LiMO2中锂层的四面体位置来补充消耗的Li+,从而提供了维持结构稳定所需的额外结合能,这一阶段的充电比容量可达120 mAh·g-1以上。第二部分是在充电电压高于4.5 V时,从曲线中可以看到一个很长的平台区域,其对应的是Li2MnO3组分的活化,平台至4.8 V截止电压之间的比容量可超过200 mAh·g-1。目前的观点认为,在4.5 V平台至4.8 V截止电压阶段的过渡金属元素均处于高价态,因此很难继续氧化至更高的价态,所以为了保持电荷平衡,氧离子会从表面结构中脱出,以氧气的形式释放[58]。
m相的活化,此时富锂材料中组分LiMO2中的Li+从锂层脱出进入电解液,迁移至负极,并伴随着过渡金属Ni2+氧化成Ni4+(三元富锂材料中还包括Co3+氧化成Co4+)[8],遵循传统层状嵌脱锂材料的机理,即LiMO2→Li++MO2+e-,并且在反应过程中Li2MnO3中锰层中位于八面体位置的Li+扩散至LiMO2中锂层的四面体位置来补充消耗的Li+,从而提供了维持结构稳定所需的额外结合能,这一阶段的充电比容量可达120 mAh·g-1以上。第二部分是在充电电压高于4.5 V时,从曲线中可以看到一个很长的平台区域,其对应的是Li2MnO3组分的活化,平台至4.8 V截止电压之间的比容量可超过200 mAh·g-1。目前的观点认为,在4.5 V平台至4.8 V截止电压阶段的过渡金属元素均处于高价态,因此很难继续氧化至更高的价态,所以为了保持电荷平衡,氧离子会从表面结构中脱出,以氧气的形式释放[58]。

图3-3 0.5Li2MnO3·0.5Li Ni0.5Mn0.5O2扣式电池首次充放电曲线(2.0~5.0 V)[59]
对于富锂材料在4.5 V处的平台,Armstrong等[60-63]提出了析氧机理:Li2MnO3组分中O2p键的氧化,(O2-从材料晶格中析出)同时伴随Li+的脱出,最终以“Li2O”的形式从电极材料中脱出,同时为了电荷平衡,表面的过渡金属离子从表面迁移到体相中占据锂离子脱出留下的空位,从而导致脱出的Li+不能全部回嵌至富锂材料的体相晶格中而导致首次不可逆容量损失,通过计算发现其理论放电比容量可以达到261 mAh·g-1;Armstrong等[53]通过实验手段采用原位的DEMS 检测到Li[Ni0.2Li0.2Mn0.6]O2材料在首次充电至4.5 V时有O2析出;Park等[64]通过原位的电池内压测试证实在电压高于4.4 V时有氧气析出;Koyama等[33]用第一性原理计算也证明了4.6 V平台为O2p的氧化;Weill等[65]通过电子衍射的结果也证实了在富锂材料的首次充电过程中,氧的析出使材料的结构发生了重排,材料由一种结构大体上类似于O3-LiCoO2的层状材料转变成另一种新的具有电化学活性的层状材料MO2。
虽然目前析氧机理得到了广泛认同,但是该机理还存在以下几个问题[56]:
(1)实验中析出的氧气没有进行定量化的计算,无法证实4.5 V平台的所有容量均由氧气的析出产生;
(2)虽然有些实验证明了在氧析出以后,结构发生了重排,并形成了新的层状结构,但O,Ni,Mn离子是具体如何迁移重排的,还没有得到解答;
(3)假设在首次充电完成后,材料结构发生重排,并形成了新的理想的层状结构,但为什么在后续的循环过程中,只有0.6~0.7个锂离子参与脱嵌反应。
此外,由于4.5 V平台至4.8 V截止电压阶段的过渡金属元素均处于高价态,很难继续氧化至更高的价态,因此有学者提出氧阴离子-过氧/超氧阴离子(O2-/O22-(O2-))氧化还原电对来解释富锂材料的高比容量[66-68]。Assat等[69]从分子轨道理论对这一概念做出了详尽的解释,简单来说就是,金属阳离子与氧阴离子在成键时会使氧的高能量级非键轨道与金属-氧轨道发生重叠,具有这种特征的氧化物在发生氧化还原反应时存在氧阴离子可逆得失电子的过程,从而可以参与电荷补偿而贡献可逆容量,如图3-4所示,具有这种特征的材料通常具有很高的锂含量或含有高价态过渡金属阳离子[15]。(https://www.daowen.com)
很多学者也通过实验和理论计算,进一步完善了对氧阴离子氧化还原理论的研究。Li等[70]通过实验证明了氧阴离子参与电化学反应的理论,其结果如图3-5所示。由原位X射线衍射和拉曼光谱结果能够看出Li1.2Ni0.2Mn0.6O2材料的前两周充、放电循环过程中,沿晶体c轴方向的O--O-(过氧二聚体)可逆氧化还原过程。Ben等[71]通过理论计算电子局域函数明确定位富锂氧化物结构中的氧原子孤对电子,并对其在氧化还原活性中的作用进行了细致讨论,提出了阴离子氧化还原活性的统一理论。通过实验和理论计算,揭示了氧阴离子参与电化学反应以及富锂材料高比容量的来源。

图3-4 氧化物的能带结构和阴离子氧化还原机理示意图[38]

图3-5 富锂锰基材料前两周电化学循环中原位X射线衍射谱和拉曼光谱[70]
(a)X射线衍射谱;(b)拉曼光谱
除了被大家普遍接受的氧阴离子氧化还原理论之外,近期美国加利福尼亚大学圣塔芭芭拉材料系的Maxwell 等[72]对于传统插层机理下晶格氧的可逆氧化还原提出了质疑,基于Li-Mn-O相图的第一性原理计算,提出了高价锰的电荷补偿新机理,Li2MnO3→Li2-xMnO3+Li++xe-,其中Li2-xMnO3中的Mn为+4和+7价的混合。在第一次放电时,四面体中的锰离子不太可能回到它们原来的八面体中,一个四面体中的锰离子可以迁移到任何一个位置与四个八面体位点共用一个面。在第一次放电后,在Li2MnO3组分中的阳离子排序更像无序的岩盐相,而不是层状Li2MnO3,随着局部锰离子环境变得多样化,二次充电电压曲线将不同于第一次充电电压曲线,产生较大的容量贡献。进一步循环时,锰离子的进一步重排引起电压衰减。如果锰离子在八面体和四面体之间迁移的动力学是限速的,那么放电可以通过Mn7+还原为Mn5+进行,并不需要锰离子迁移,因为Mn5+更倾向于四面体配位。Mn4+/Mn7+与Mn5+/Mn7+氧化还原电对之间的电压差将在电压曲线上表现为极化,锰离子逐渐迁移到八面体位置会释放热量。另外,充电结束时,剩余八面体中的Mn4+还原为Mn3+的过程同样可以在没有Mn迁移的情况下进行。由于+7价的Mn化合物在高能射线下容易分解,再加上Mn—O的共价特性,一般测试结果都是Ok边吸收谱的弛豫,目前测试手段较难为新机理提供足够的实验证据。
由此可见,尽管对富锂材料高比容量来源的探究有了更深层次的认识,但仍有很多问题等待研究者去解答,仍需进一步去完善或者提出其他一些全新的机理。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






