尽管高镍三元材料有着比容量高的优点,且在能量密度等方面有较大优势,但是也有一些不可忽略的缺点存在,阻碍了其在动力电池领域的大规模应用,如循环性能、安全性能、储存性能较差等[36]。
随着高镍三元材料中镍含量的增加,有几个问题也随之变得严重[16]:
(1)阳离子混排。由于Ni2+与Li+半径接近,在合成过程中部分Ni2+会占据Li+位从而发生阳离子混排,干扰了锂离子的迁移率。阳离子混排现象在充电过程中也会出现,这就造成了高镍材料首周库仑效率不高。此外,在充、放电循环期间,Ni2+可以从镍平面(3a)迁移到锂平面(3b),这会导致其结构由层状结构向缺陷尖晶石/无序的岩盐转变,同时阻断了Li+的迁移通道。
(2)微裂缝(图2-15)以及表面残碱问题。虽然高镍NCM材料相比LiNiO2 等材料结构更稳定,锂离子嵌入和嵌出的可逆性更好,体积变化相对较小(小于10%),但是在二次颗粒合成过程中存在不同程度的应力和畸变,会产生应变与微裂纹;并且在循环过程中高镍NCM材料也会在内部有微应变和裂纹的形成,这些应变会产生机械断裂,使材料暴露新的表面与电解质溶液相互接触,导致更多副反应的发生和活性锂离子的损失,并随之形成电阻表面膜,该膜会导致高阻抗,引起高镍NCM在循环后容量衰减[37]。另一个问题是高镍三元材料表面残留含锂杂质,这些表面杂质会与水和氧气发生反应生成Li2CO3和LiOH等,在电极材料表面形成一种绝缘层,阻碍Li+的扩散和电子的传输[38,39],如图2-16所示。有研究表明,充、放电深度越深,材料裂纹扩展越快,循环容量衰减越快[40]。因此,在实际实验过程中可以通过控制充、放电电压来控制材料充、放电深度,达到延长使用寿命的目的。此外,表面包覆也能缓解材料在充、放电过程中的体积变化,抑制颗粒在循环过程中产生微裂纹,改善其循环性能[41]。
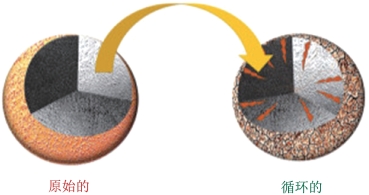
图2-15 长时间循环后裂缝的产生[39]
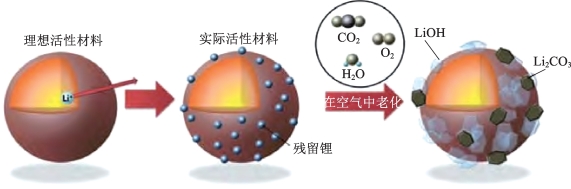
图2-16 高镍材料在空气中暴露后的表面变化[39]
(3)表面反应不均匀/表面结构不稳定。由于Li+扩散受动力学因素影响,锂的脱出量增多导致过渡金属离子还原,材料为了维持其电中性,易在其表面形成新相及孔隙,从而导致高镍材料结构的不稳定。电极材料从表层开始脱锂,在充电过程中加速了结构的不稳定性,表层结构过度脱锂的同时,高镍三元材料会从层状结构向尖晶石结构以及惰性(NiO型)岩盐结构转变,在这个过程中伴随着氧气的产生,使得电池的安全性存在一定的隐患,如图2-17所示。
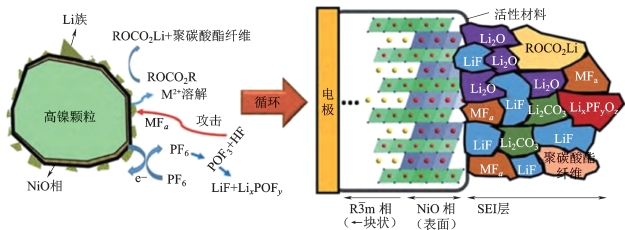
图2-17 高镍正极材料表面的微观结构和组成[42]
(4)热稳定性差(图2-11)。材料的热稳定性很重要,它与电池的安全性能息息相关,电池中正极材料的热分解温度往往是影响电池热失控的关键因素。三元材料中镍的含量越高,热分解温度越低,其热稳定性越低。
高镍三元正极材料的改性方法主要是离子掺杂、表面包覆和微观结构设计等。
掺杂改性是将其他金属离子或一些非金属离子掺杂进材料中,通过改变材料的晶格常数或元素价态来提高材料的稳定性,但是不影响材料主体晶格结构变化的一种方法。掺杂改性可以提高正极结构的稳定性,同时可以防止三元材料从层状结构到岩盐型结构的相变,有效提高电子电导率和离子电导率,降低阳离子混排程度。阳离子掺杂常用的元素有Al,Mg,Ti,Zr等[43],阴离子掺杂主要是掺入与氧元素离子半径相近的F原子。
离子掺杂中,Al和Mg由于低成本而最受关注。Al是最常用的阳离子掺杂元素,它对层状正极材料有很好的稳定作用。通常情况下,材料放电比容量会随着掺杂剂含量的增加而降低,但结构稳定性随之增加[44-46]。因此,对高镍材料的Al离子掺杂方法研究集中在优化掺杂比,使用最少量的掺杂剂使稳定效果最大化。
Aurbach等[47]研究了Al掺杂对LiNi0.5Co0.2Mn0.3O2(NCM523)的影响。Al掺杂的NCM523表现出更高的电化学稳定性,每个循环的容量衰减仅为0.02%,而未掺杂的NCM523在30 ℃下显示出每循环0.07%的高容量衰减。Al掺杂可以提供更加稳定的层状结构,且在电化学循环之后,Al掺杂的NCM523表现出较低的膜和电荷转移阻力以及较低的锂离子插入活化能。这是由于Al掺杂抑制了正极材料与电解质的副反应发生。就结构稳定性而言,将Al引入主体结构有效地防止了在脱锂过程中形成氧空位,通过抑制氧气释放阻止了镍从过渡金属位点迁移到锂位点,从而稳定了正极结构。
对Mg元素掺杂的研究也很多。Mg是一种非常有前景的掺杂元素,Mg2+具有与Li+相似的离子半径,可以替代Li位点,从而使层状结构更加稳定[42]。Liao等[48]研究了不同的Mg掺杂量下,Mg掺杂高镍三元材料的局部结构及其电化学性能。实验结果表明,当Mg2+的摩尔分数为0.03时,NCM材料在室温和高温(55 ℃)下的电化学性能最佳;掺杂改性后的LiNi0.57Mg0.03Co0.25Mn0.15O2材料在室温下循环30次后,其容量保持率由77%增加到93%,循环性能显著提升。
同样,在高镍材料中用Ti4+掺杂也有助于改善结构稳定性。Wu等[49]首先通过共沉淀法成功合成了层状高镍正极材料LiNi0.9Co0.1O2,然后用不同含量的Ti4+掺杂这种本体材料。将未处理的本体材料用UM表示,分别将摩尔百分数为3%,5%,7%,9%的Ti4+掺杂的样品用3%-Ti PM,5%-Ti PM,7%-Ti PM和9%-Ti PM表示。
图2-18中的扫描电子显微镜(Scanning Electron Microscope,SEM)图像显示,PM样品的表面比UM样品更粗糙,表明在Ti掺杂后材料会发生一些表面反应。图2-18(d)中TOF-SIMS横截面化学映射显示出颗粒中均匀分布的Ti,表明Ti元素已渗透到二次颗粒中而不是包覆在表面。所有的材料都具有R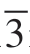 m空间群的六方α-NaFeO2结构。如图2-18(e)所示,PM样品的(003)峰显示出较小的衍射角,层间距的扩大可能是由于Ti4+掺杂引起电荷补偿,从而导致Ni3+(0.060 nm)还原为半径较大(0.069 nm)的Ni2+[50],后者趋于迁移至锂层,形成预构阳离子混排层并导致材料结构的有序度下降。
m空间群的六方α-NaFeO2结构。如图2-18(e)所示,PM样品的(003)峰显示出较小的衍射角,层间距的扩大可能是由于Ti4+掺杂引起电荷补偿,从而导致Ni3+(0.060 nm)还原为半径较大(0.069 nm)的Ni2+[50],后者趋于迁移至锂层,形成预构阳离子混排层并导致材料结构的有序度下降。
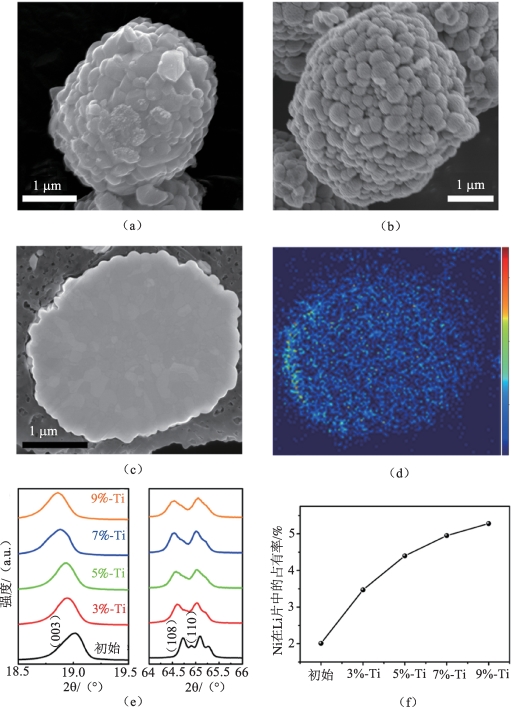
图2-18 LiNi0.9Co0.1O2本体(UM)和Ti掺杂改性样品(PM)的形貌、结构
(a)UM的SEM图像;(b)5%-Ti PM的SEM图像;(c)5%-Ti PM的横截面SEM图像;(d)TOF-SIMS图像,证明Ti在5%-Ti PM中的定位;(e)所有样品的局部放大的XRD曲线;(f)Li位置中Ni2+的占有率与Ti含量的函数关系[49]
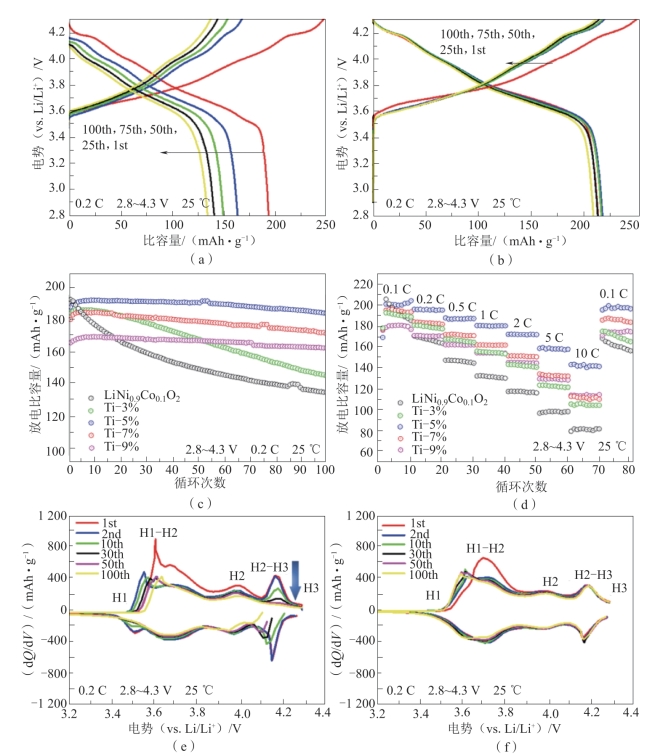
图2-19 LiNi0.9Co0.1O2本体(UM)和Ti掺杂改性样品(PM)的电化学性能
(a)UM在第1至100次循环的0.2 C下的充电/放电曲线;(b)5%-Ti PM在第1至第100次循环的0.2 C下的充电/放电曲线;(c)在0.2 C下,100次循环内所有样品的性能;(d)所有样品的倍率能力范围为0.1 C~10 C。所有测试均在2.8~4.3 V(1 C=190 mAh·g-1)下进行;(e),(f)图3(a)~(b)的相应微分容量与电压曲线[49]
他们还对材料进行了电化学性能测试。如图2-19(a)~(c)所示,在0.2 C的条件下(2.8~4.3 V,1 C=190 mA·g-1),UM样品的放电比容量迅速下降,从193.9 mA h·g-1降到135.1 mAh·g-1,100次循环后容量保持率为69.68%。随着掺杂的Ti含量的增加,PM样品的循环性能逐渐提高。经过100次循环后,3%-Ti,5%-Ti,7%-Ti和9%-Ti PM样品的容量保持率分别达到78.53%,97.94%,95.09%和97.96%。然而,过量的Ti4+掺杂似乎影响放电比容量,如7%-Ti和9%-Ti PM样品所示,见图2-19(c)。图2-19(d)比较了从0.1 C到10 C的每十个循环的所有样品的倍率容量,也得出了类似的结论。当以5 C和10 C倍率循环时,UM样品提供了100.2 mAh·g-1和83.4 mAh·g-1的可逆容量,而5%-Ti PM分别提供了159.5 mAh·g-1和143.4 mAh·g-1的可逆容量。因此,具有适当厚度的预构阳离子混排层可以稳定整体结构,并为Li+提供平滑的传输通道;但是尽管结构变得更加稳定,Li层中过量占据的Ni2+同样会阻碍Li+传输。
图2-19(e)、(f)中的微分容量曲线(dQ/dV)分别对应图2-19(a)、(b)中的充、放电曲线。如图2-19(e)、(f)所示,有三个不同的氧化还原峰,分别对应从H1到H2和H3的相变。对于UM而言,长时间循环中存在明显的放电电压衰减以及在4.20 V附近的氧化还原峰的强度有所降低,表明H3相逐渐消失,这应该是UM样品容量衰减更快的原因[51]。而对于5%-Ti PM样品而言,在100个循环内峰值强度的变化几乎可以忽略,dQ/dV曲线的重叠表明预构阳离子混排层有助于改善H2-H3相变的可逆性。
Liu等学者证实了Ti4+掺杂可以改善H2-H3相变的可逆性,使微裂纹和结构转变的产生得到抑制,并同时提升了高镍正极材料的容量和稳定循环性[52]。
此外,还有学者研究了Mo掺杂对高镍正极材料结构、形貌和电化学性能的影响。Su等[53]使用一系列不同掺杂量的Mo元素改性NCM811材料。Mo掺杂前后的相应结构示意图如图2-20所示。
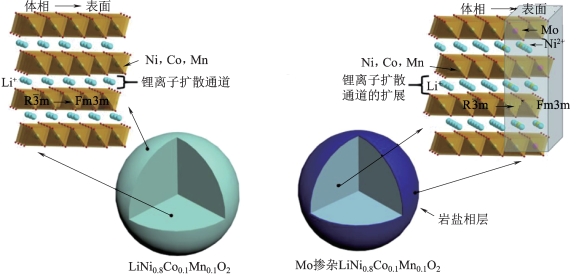
图2-20 Mo掺杂和原始样品的示意图[53]
将Mo掺杂的质量分数为0,0.5%,1%和2%的改性样品分别命名为Mo-0,Mo-0.5,Mo-1和Mo-2。他们通过等离子体光电直读光谱(Inductively Coupled Plasma,ICP)、X射线衍射(X-ray Diffraction,XRD)、X射线光电子谱(X-ray Photoelectron Spectroscopy,XPS)、电化学阻抗谱(Electrochemical Impedance Spectroscopy,EIS)和循环伏安(Cyclic Voltammetry,CV)等研究发现,一方面,Mo掺杂可以促进循环前高镍材料表面岩盐相的形成,不仅使结构表面更加坚固,而且显示出在循环过程中抑制岩盐相进一步生成的能力;另一方面,一定量的Mo掺杂会扩大层间距,从而提供更平滑的Li+传输通道。
为了研究表面岩盐相和晶格膨胀对材料的影响,他们还测试了样品的电化学性能,如图2-21所示。图2-21(a)是电压为2.75~4.3 V,0.1 C,0.2 C,0.5 C,1 C,2 C和5 C下的倍率性能测试。Mo掺杂电极表现出更高的放电比容量,特别是在0.1 C下的Mo-1样品,其初始放电比容量接近220 mAh·g-1,远高于未掺杂样品的189.6 mAh·g-1。未掺杂样品和Mo掺杂样品在2.75~4.3 V下的初始放电曲线和循环性能见图2-21(b)、(c)。Mo-1电极具有最高的初始值,其放电比容量为184.1 mAh·g-1,而Mo-0,Mo-0.5和Mo-2的放电比容量分别为179.3 mAh·g-1,176.9 mAh·g-1,和175.4 mAh·g-1。Mo-1在100次循环后的容量保持率为92.4%,高于原始样品87.9%和另外三种样品。
图2-21(d)、(e)展示了在较高电压范围(2.75~4.5 V)内,1 C下原始和Mo掺杂样品的初始充、放电曲线和循环性能,用以研究Mo掺杂对高压电化学性能的影响。当截止电压升至4.5 V时,Mo掺杂电极的初始放电比容量略低于原始电压样品,但经过活化后明显增加。而且,Mo-1样品在100次循环后保持最高容量保持率,为85.2%。研究还发现,无论截止电压是4.3 V还是4.5 V,Mo-2电极都表现出最差的初始放电比容量和容量保持率,表明过量的Mo掺杂对高镍正极材料的电化学性能不利,适量的Mo掺杂可明显改善其循环性能。过量Mo掺杂的样品的电化学性质恶化可能是由于过厚的岩盐相导致Li+迁移受限。Mo掺杂样品的更好的容量保持可能是由于在充、放电过程中形成表面岩盐相,提高了结构稳定性。此外,Mo掺杂可能会抑制循环过程中岩盐相的进一步形成。这些结果与XRD和XPS数据的分析非常吻合。综上所述,1%(质量分数)掺杂的Mo掺杂材料表现出最好的循环稳定性和优异的电化学性能,该结果表明制备具有表面岩盐相的高镍材料是改善结构稳定性和电化学性能的有效策略。
表面包覆也是一种常用的改性方法。该方法是通过在材料表面涂覆一层稳定的金属氧化物或非氧化物保护层,从而抑制材料与电解液接触,减少副反应的发生,提高材料表面结构的稳定性[54],这种方法可以显著提高循环稳定性;电导率较高的包覆物可以提升电子电导率和锂离子扩散速率,提升材料的倍率性能;一些涂层可以减少锂残留物的量或抑制有机电解质和活性正极材料之间的副反应,并且可以充当减轻体积收缩或膨胀的保护膜。目前包覆物主要包括碳、氧化物、锂盐、磷酸盐、氟化物等[55-58]。

图2-21 所有样品的电化学性能[53]
(a)不同电流密度下的倍率性能;(b)不同倍率下样品的放电曲线;(c)在2.75~4.3 V电压范围,1 C的循环性能;(d)在2.75~4.3 V电压范围,1 C处的初始充、放电曲线;(e)在2.75~4.5 V电压范围,1 C的循环性能;(f)在2.75~4.5 V电压范围,1 C处的初始充、放电曲线
有研究表明,AlPO4涂覆的LiNi0.8Co0.1Mn0.1O2改善了本体材料的热稳定性和电化学性质[59]。循环后溶解在电解质中的Co和Ni的浓度分别为80和20 ppm,Mn离子溶解可忽略不计。显然,表面AlPO4层抑制了金属离子溶解。AlPO4涂层还使去锂化的正极材料的放热反应最小化,避免引发LIB的“热失控”。Cho等[60]使用AlPO4涂覆的LiNi0.6Co0.2Mn0.2O2 作为正极材料的电池表面温度小于125 ℃,而有AlPO4涂层的正极为LixCoO2的电池温度超过170 ℃。AlPO4包覆后的改进机理主要是通过在活性材料和电解质之间的界面处形成保护层来使有害的副反应最小化。
为了进一步改善表面包覆层/涂层的电子电导率和Li+导率,Park等[61]尝试用V2O5涂覆颗粒表面以获得多壳涂层包覆的正极材料,如图2-22所示。他们使用NH4VO3作为前驱体,因为离子化的VO3-可以与LiOH中的Li+及颗粒表面上的Li2CO3反应。该涂覆方法在400 ℃退火后产生V2O5-LixV2O5-LiNi0.75-zCo0.11Mn0.14VzO2 的多壳层。这种涂层防止了与空气和电解质中的水分的副反应的发生,即使在608 ℃下也可以提供稳定的循环性能。
除了在材料表面涂覆一层包覆层,还有学者尝试在材料表面涂覆双包覆层以改善高镍三元正极材料的电化学性能。Chen等[62]合成了层状LiNi0.8Co0.1Mn0.1O2正极材料,然后采用离子导电的Li3PO4和电子导电的聚吡咯(Polypyrrole,PPy)聚合物为双导电包覆层对材料进行表面改性。Li3PO4常用作正极材料的表面包覆材料,它具有良好的离子导电性和稳定的P=O键,促进Li+在电极/电解质界面处的扩散。此外,PO43-聚阴离子可与正极表面上的Li2O/LiOH残基反应,从而降低正极材料的pH。然而,Li3PO4不能提高材料的电子传导性。PPy是一种导电聚合物,它对于改善电子传导性和稳定材料的电极/电解质界面非常有效,然而PPy的单层包覆层不能处理颗粒表面上的锂残留物和正极材料的相对较低的离子导电性。(www.daowen.com)
他们研究了不同量的Li3PO4和PPy涂层对LiNi0.8Co0.1Mn0.1O2 的电化学性能的影响,如图2-23所示。图2-23(a)比较了原始LiNi0.8Co0.1Mn0.1O2,LP-2(Li3PO4包覆量为2%),PPy-3(PPy包覆量为3%)和PPy-LP电极在0.1 C(0.1 C=20 mA·g-1),2.8~4.5 V之间的初始充、放电曲线。原始LiNi0.8Co0.1Mn0.1O2正极显示出最高的初始放电比容量,为206 mAh·g-1,LP-2样品具有最低的初始放电比容量,仅为198 mAh·g-1,这是由于Li3PO4没有电化学活性。双导电包覆层材料PPy-LP样品的初始放电比容量为203 mAh·g-1,库仑效率为83.4%,略低于未改性样品(库仑效率为84.8%)。一方面是因为少量Li+与(NH4)2HPO4 反应生成的Li3PO4可能会在涂覆过程中损失;另一方面,一些Li+可能在第一次充、放电过程中插入PPy,导致库仑效率降低。
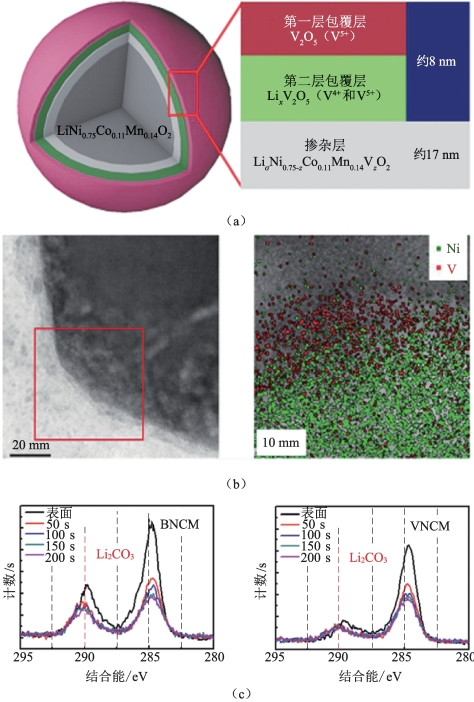
图2-22 多壳涂层的高镍正极材料的示意图及其涂层效果[61]
(a)V2O5改性后的具有多壳表面结构的LiNi0.75Co0.11Mn0.14O2正极材料;(b)V2O5涂覆的高镍正极材料的横截面TEM图像和Ni和V的分布情况(c)未涂覆(BNCM)和V2O5-涂覆(VNCM)的高镍材料的XPS光谱
图2-23(b)显示未改性的和表面改性的正极材料在0.1 C下的循环特性,它们的容量保持率有显著差异,表面改性后正极的容量保持率得到改善。在0.1 C下进行50次循环后,未改性样品的容量从206 mAh·g-1急剧下降至177.2 mAh·g-1,容量保持率仅为86%;而LP-2,PPy-3和PPy-LP样品在50个循环后的容量保持率分别为93.3%,93.9%和95.1%。可以看出,PPy-LP样品组装的电池在所有样品中表现出最佳的容量保持率,表明由Li3PO4和PPy组成的双导电包覆层可以有效保持循环稳定性。
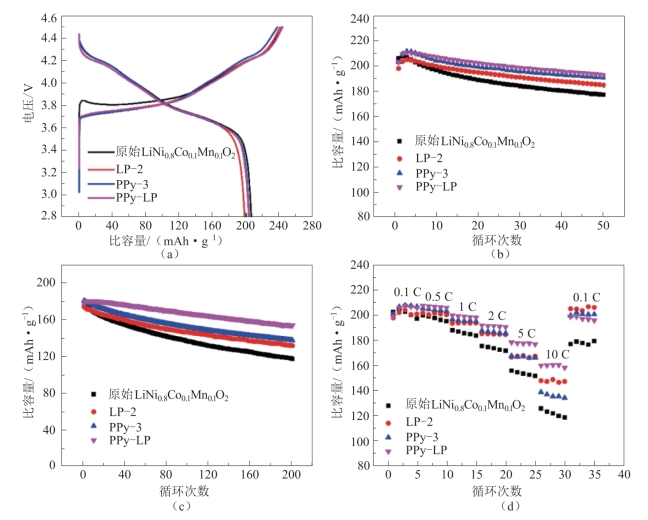
图2-23 原始LiNi0.8Co0.1Mn0.1O2及Li3PO4和PPy改性后样品(LP)的电化学性能
(a)初始充、放电曲线;(b)0.1 C时的循环特性;(c)1 C时的循环特性;(d)原始LiNi0.8Co0.1Mn0.1O2,LP-2,PPy-3和PPy-LP样品在25 ℃,2.8~4.5 V电压下的倍率特性[62]
为了进一步证明双导电涂层对改善循环稳定性的影响,他们使未改性的样品和表面改性的样品在1 C下循环以加速容量衰减,如图2-23(c)所示。与图2-23(b)相比,1 C下材料的循环稳定性的改善更明显。未改性样品的初始放电比容量为178.3 mAh·g-1,200次循环后容量保持率仅为65.8%,这可能是由于其与电解质的高表面反应性。表面改性的样品容量保持率提升很大,LP-2样品约为75.7%,PPy-3样品约为76.1%。而PPy-LP样品表现出最佳的循环稳定性,在200次循环后仍具有约86.5%的容量保持率。
图2-23(d)研究了所有样品的倍率特性。未改性的LiNi0.8Co0.1Mn0.1O2样品在所有样品中表现出最差的倍率特性,当放电倍率增加时其放电比容量急剧下降。这是因为电解质会与颗粒表面上的活性材料反应,破坏表面结构并增加电荷转移电阻。LP-2和PPy-3样品显示出比原始样品更好的倍率性能,其放电比容量分别为147.7 mAh·g-1和138.6 mAh·g-1。LP-PPy样品在10 C下具有最高的放电比容量,为159.7 mAh·g-1,具有最高的倍率性能。这是因为在第一层包覆层中,Li3PO4包覆的LiNi0.8Co0.1Mn0.1O2通过(NH4)2HPO4 与锂残余物在颗粒表面上反应,有效地减少正极材料表面上的锂残留量,在循环过程中极大地抑制LiF和HF的传播,减少过渡金属离子的溶解和循环中裂缝的形成。此外,离子导电的Li3PO4包覆层可以减少电荷在循环期间传递阻力并增加Li+扩散效率。在第二层包覆层中,PPy形成连续涂层,弥补了Li3PO4的缺陷。PPy包覆层减少了颗粒之间的分离以及电极的电阻,显著增强了正极材料的导电性,并且阻碍了电极和电解质之间的直接接触,从而抑制了过渡金属在正极材料表面的溶解。弹性的PPy胶囊壳也能抵抗内部压力,减少内部裂缝。这些结果表明,在LiNi0.8Co0.1Mn0.1O2正极材料上存在双导电包覆层对于改善倍率性能是十分有效的。
此外,还可以通过改进合成工艺,对高镍三元正极材料进行核-壳设计或浓度梯度结构设计,一般采用高镍材料为核,具有稳定结构的高锰材料为壳,即材料粒子的中心富镍、表面富锰,从而减少材料与电解液副反应的发生,改善材料表面结构的稳定性,使Li+平缓过渡,降低电荷转移电阻以提升材料的比容量、循环保持率、倍率性能、热稳定性等,还能提供缓冲空间以减轻循环期间产生的微应变。
Sun等[63]提出了一种核-壳结构,以高镍三元材料NCM811为核、LiNi0.5Mn0.5O2高锰材料为壳合成了一种三元正极材料,核-壳结构材料结合了NCM材料高比容量和高锰材料热稳定性良好的优点,表现出优越的循环特性。Sun等[64]又采用共沉淀法,通过连续梯度改变原料组成,制备出具有浓度梯度的核-壳结构的高镍三元材料Li[Ni0.67Co0.15Mn0.18]O2。该浓度梯度材料内部浓度均匀分布,Ni浓度从中心到表面逐渐降低,Mn浓度从中心到表面逐渐升高,避开了单纯的核-壳结构充、放电过程中组分差异过大,各自体积变化差异较大引起的核-壳结构的分离现象,表现出优异的电化学性能。当电流密度为40 mA·g-1,温度为55℃时,Li[Ni0.67Co0.15Mn0.18]O2正极材料的实际容量随着截止电压的增加而增加,例如当电压从4.3 V增加到4.5 V时,放电比容量从192 mAh·g-1增加到213 mAh·g-1,并且表现出良好的循环性能。
Yang等[65]合成了一种特殊的核-壳结构的高镍三元正极材料。他们用一种改进的共沉淀方法合成了具有特殊壳-孔结构的前体,如图2-24所示。首先,通过传统的共沉淀法合成了原始的Ni0.8Co0.1Mn0.1(OH)2前驱体(标记为PP),然后将PP加入基础溶液中用于随后的改性共沉淀过程。在此过程中,通过控制PP前驱体和过渡金属的摩尔比,使PP颗粒进一步生长成具有特殊壳-孔结构(标记为SP)的较大颗粒。将拥有不同摩尔比的前驱体/过渡金属离子合成的样品命名为NCM-0,NCM-5,NCM-10和NCM-20,分别代表加入了摩尔分数分别为0%,5%,10%,20%的PP颗粒。
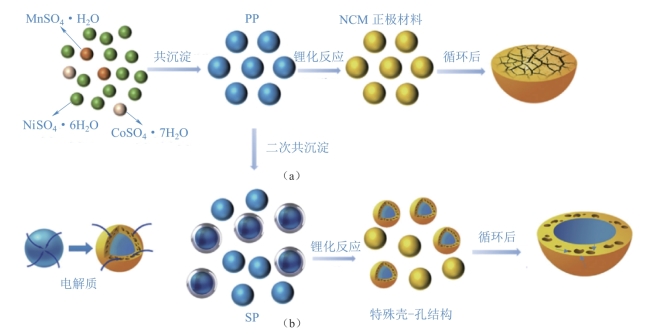
图2-24 具有特殊壳-孔结构的高镍三元前驱材料的合成和反应过程的示意图[65]
(a)合成过程图;(b)反应过程图
他们通过SEM证实了改性材料具有独特的壳-孔结构;XRD表明制备的材料具有较低的阳离子混排度;EIS显示NCM-20材料具有最低阻抗。各个材料的电化学性能如图2-25所示。图2-25(a)显示了NCM-0,NCM-5,NCM-10和NCM-20样品在0.2 C(1 C=200 mA·g-1)和2.75~4.3 V电压下的循环性能。NCM-0的最低初始放电比容量为170.3 mAh·g-1,库仑效率为77.78%,而NCM-20的初始放电比容量最高,为178.9 mAh·g-1,库仑效率达到83.35%,与原始材料相比,改性材料的放电比容量得到改善。改性材料的壳-孔结构导致电解质渗透到外层材料中,从而增加它们之间的接触。图2-25(b)说明了样品在1 C倍率下样品的循环性能,可以看出NCM-0的初始放电比容量为151.5 mAh·g-1,100次循环后容量保持率为76.17%,而NCM-20的初始放电比容量为169.7 mAh·g-1,容量保持率为90.33%。图2-25(d)显示了不同倍率下四个样品的放电比容量。可以看出,NCM-20的放电比容量优于NCM-0,在2 C时为157.3 mAh·g-1,在5 C时为144.1 mAh·g-1,这可能是由于NCM-0样品与电解质的接触面积有限,因此材料的容量不能彻底激活。所以具有壳-孔结构的NCM-20可以更好地与电解质接触,提升了材料的倍率性能和循环稳定性。
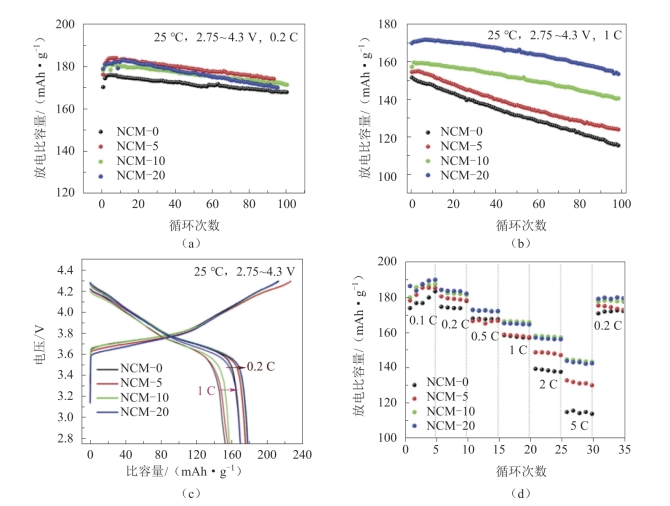
图2-25 电压为2.75~4.3 V,25 ℃时NCM-0,NCM-5,NCM-10和NCM-20样品的电化学性能[65]
(a)0.2 C的循环性能;(b)1 C的循环性能;(c)0.2 C和1 C的初始充电和放电曲线;(d)倍率性能
Tian等[66]选用LiNi0.8Co0.1Mn0.1O2作为典型的高镍正极开展研究。他们发现LiNi0.8Co0.1Mn0.1O2颗粒表面具有岩盐相,在循环过程中会引起结构失稳。他们采用简单的锰前驱体包覆法,可以自组装浓度梯度壳结构,使过渡金属在煅烧过程中迁移,形成高镍核和浓度梯度壳结构,得到了具有浓度梯度壳体的均匀层状R m LiNi0.71Co0.09Mn0.2O2材料,成功地消除了表面岩盐Fm
m LiNi0.71Co0.09Mn0.2O2材料,成功地消除了表面岩盐Fm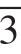 m相,提高了循环后结构的稳定性,使高镍材料具有良好的循环性能。
m相,提高了循环后结构的稳定性,使高镍材料具有良好的循环性能。
将原始LiNi0.8Co0.1Mn0.1O2材料和去除岩盐Fm3m表面结构的LiNi0.71Co0.09Mn0.2O2材料分别命名为PM和RM。在室温下,PM和RM在0.1 C、2.8~4.5 V电压下的循环性能如图2-26(a)所示。对应的电化学数据如表2-1所示。PM的初始放电比容量为195.4 mAh·g-1,库仑效率为84.8%。100次循环后,容量保持率为74.7%,放电比容量为145.9 mAh·g-1。虽然RM的初始放电比容量较低,只有178.4 mAh·g-1,库仑效率较低,为74.0%,但循环稳定性较好,100次循环后放电比容量保持在164.4 mAh·g-1,容量保持率为92.2%。
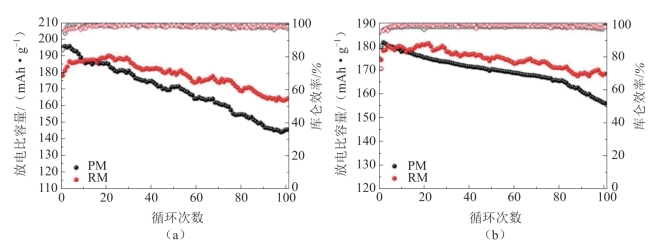
图2-26 在0.1 C(1 C=200 mAh·g-1)和室温下,PM和RM样品的循环性能[66]
(a)2.8~4.5 V;(b)2.8~4.3 V
表2-1 室温下,PM和RM在0.1 C,2.8~4.5/4.3 V电压下的循环的电化学数据[66]
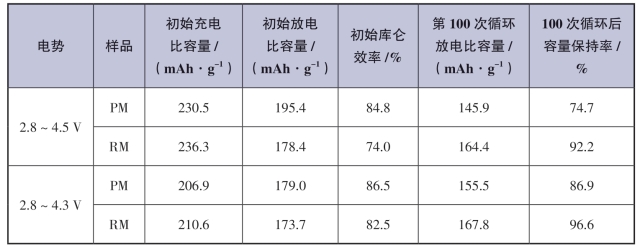
综上所述,Tian等成功地去除了NCM811材料表面岩盐Fm3m相,该相不利于材料的结构稳定性和循环性能。所得的LiNi0.71Co0.09Mn0.2O2材料含有均匀的层状R3m相,且层状R3m相具有浓度梯度富锰外壳,提高了结构的稳定性、循环性能和热稳定性。
Chen等[67]还通过改进的合成工艺成功地合成了一种分层的微/纳米结构的LiNi0.8Co0.1Mn0.1O2材料,其合成方法如图2-27所示。在该课题组之前的工作中已经证实了层状正极材料的倍率性能可以通过增加暴露的{010}活性面的面积来提高[68-70]。他们通过在共沉淀反应期间调节NH3·H2O浓度,使初级纳米片可以有规律地多层自组装,沿着[001]晶轴堆叠。在这项实验中,由高浓度(4 mol/L)NH3·H2O合成的前驱体烧结的样品标记为“HLNCM”,由低浓度(2 mol/L)NH3·H2O合成的前驱体烧结的样品标记为“LLNCM”。
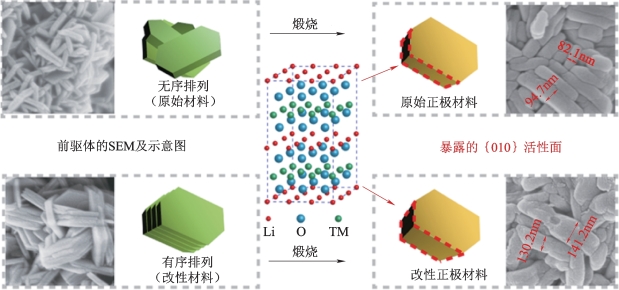
图2-27 前驱体及其相应的最终原始/改性LiNi0.8Co0.1Mn0.1O2示意图[67]
他们测试了HLNCM和LLNCM的电化学性能,其结果如图2-28所示。图2-28(a)中比较了HLNCM和LLNCM材料的倍率性能。在所有不同的倍率下,HLNCM的比容量总是优于LLNCM,特别是在10 C倍率下,HLNCM的放电比容量约为146 mAh·g-1,而LLNCM的放电比容量只有98 mAh·g-1。HLNCM和LLNCM的各种倍率的代表性放电曲线如图2-28(b)所示。对于HLNCM和LLNCM,各种倍率下的初始放电比容量列于表2-2中(详见第47页)。从图2-28(a)、(b)和表2-2可以很容易地得出结论,HLNCM的倍率性能通过增强的{010}活性平面得到极大改善,特别是在高倍率下。图2-28(c)将电池在1 C和10 C下循环100次,发现HLNCM的容量和循环稳定性均高于LLNCM。HLNCM/LLNCM的初始放电比容量在1 C和10 C时分别为186.3/159.6 mAh·g-1和156.2/101 mAh·g-1。即使经过100次循环,HLNCM的放电比容量仍然高于LLNCM的放电比容量。同时发现,HLNCM和LLNCM之间的放电比容量差距在10 C时比在1 C时高得多,这说明改性材料的在高倍率下的性能得到了显著改善。
不难看出,HLNCM的优异倍率性能证明了暴露的{010}面在提高层状正极材料的倍率性能方面具有优势。然而,增加{010}面的暴露区域也意味着增加电解质接触面积,所以有必要在低倍率下检查电池的循环性能。图2-28(d)显示了HLNCM和LLNCM在0.2 C下的容量和循环稳定性。HLNCM和LLNCM的第一次放电比容量分别为201.6 mAh·g-1和193.1 mAh·g-1。LLNCM在0.2 C下的放电比容量类似于商业NCM811材料的平均放电比容量。经过100次循环后,HLNCM的放电比容量保持在约183.6 mAh·g-1,容量保持率高达91%;而LLNCM的放电比容量则降至160.7 mAh·g-1,容量保持率仅为87%。HLNCM优越的循环稳定性表明增加{010}面的暴露区域可以提高层状正极材料的倍率性能而不会遭受更快的容量衰减。
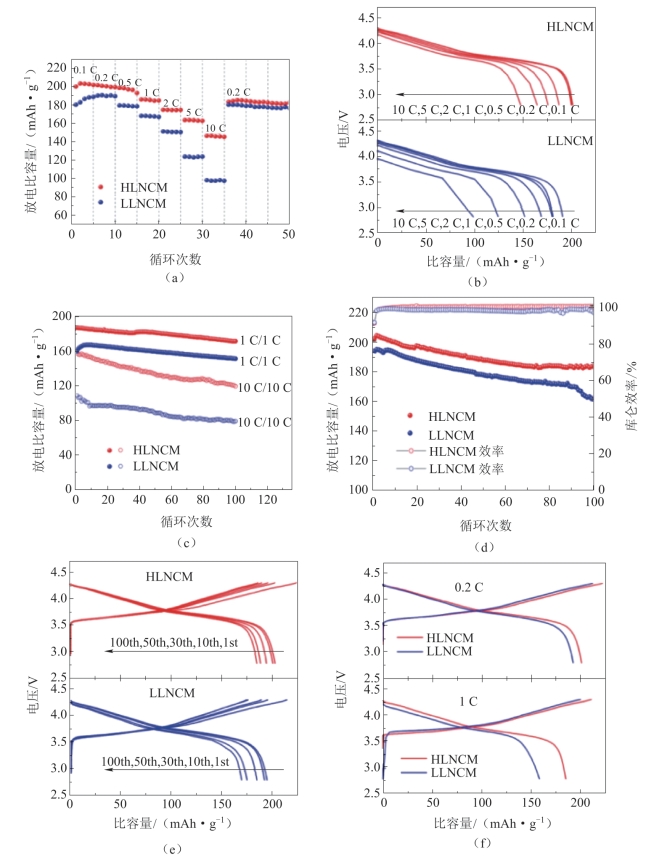
图2-28 LLNCM和HLNCM的电化学性能[67]
(a)倍率性能;(b)不同倍率下样品的放电性能;(c)1 C和10 C的循环性能;(d)0.2 C下的循环性能和库仑效率;(e)在第1,10,30和50次循环中的0.2 C下的放电曲线;(f)0.2和1 C时的初始充电和放电电压曲线
表2-2 各种倍率下HLNCM和LLNCM的初始放电比容量[67] mAh·g-1
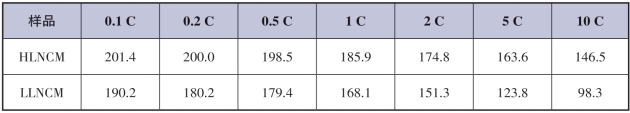
图2-28(e)为两种样品在0.2 C倍率下的充电和放电曲线。两种材料的曲线之间的变化归因于长循环期间结构变化引起的极化。然而,与传统材料相比,改性材料具有更小的变化和更好的循环性能。这一结果意味着增加的{010}平面对低倍率下循环性能没有不利影响;相反,受益于暴露的活性面,加快了Li+的传输,有助于缓解循环期间增加的极化。除此之外,图2-28(f)中对比了0.2 C和1 C倍率下HLNCM和LLNCM的第一周电压曲线。HLNCM和LLNCM材料的初始库仑效率在0.2 C倍率下很接近,分别为90.6%和90.8%。然而,结果在1 C下差别较大:HLNCM的初始库仑效率为87.84%,而LLNCM的为79.18%。HLNCM在高倍率下库仑效率的增强归因于暴露的{010}面的增加,这为Li+提供了快速传输通道。
综上所述,Chen等通过简单的方法得到了改性的大量暴露{010}活性晶面的高镍材料(HLNCM),这种材料显示出良好有序的层状结构和较低的阳离子混排度。其电化学结果表明,HLNCM比原始化合物LLNCM具有更高的可逆容量和更好的倍率能力。此外,HLNCM还表现出优异的倍率性能和循环稳定性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




