电化学性能一般指电池的充放电性能、循环性能、倍率性能等。
图2-7展示了一些常见的正极材料的平均放电电位及比容量,供读者们参考。图中LCO表示“钴酸锂”,LMO表示“锂锰氧化物”,NCM表示“镍钴锰氧化物”,NCA表示“镍钴铝氧化物”,LCP表示“磷酸钴锂”,LFP表示“磷酸铁锂”,LFSF表示“锂铁氟代硫酸盐”,LTS表示“锂钛硫化物”。
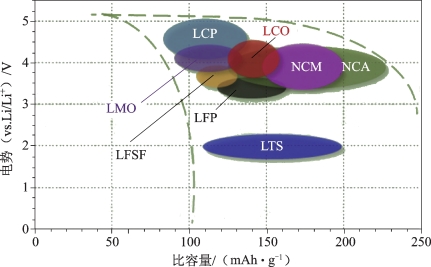
图2-7 一些常见的正极材料的平均放电电位及比容量[26]
图2-8为LiNixCoyMn1-x-yO2 三元材料的充、放电曲线图。因为三元材料的电化学反应为均一固相反应,所以其在反应过程中没有新相生成,晶体结构也不发生变化,电压随着锂离子的脱出/嵌入不断升高/降低,表现在充、放电曲线上则为不会出现固定的电压平台[27,28]。当充电电压小于4.5 V时,发生的主要电化学反应是Ni2+/Ni4+或Ni3+/Ni4+电对的氧化还原反应;当充电电压大于4.5 V时,Co元素发生反应,从Co3+被氧化为Co4+,在此过程中,Mn元素不参与氧化还原反应,对材料的比容量没有贡献,Mn4+仅作为骨架元素来稳定材料的结构[29,30];在更高电压下,NCM三元材料中的Li+在充、放电过程中的脱出超过一定限度时就会发生晶格氧逃逸,如果此时继续充电,则会有新相MO2(M=Ni/Co/Mn)出现,从而使其电化学性能迅速下降。因此一般将三元正极材料的截止电压设置为小于4.4 V,但是此时材料的比容量无法达到Li+完全脱出时的278 mAh·g-1。
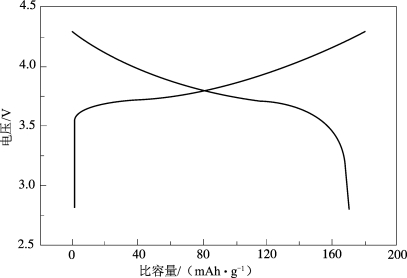
图2-8 LiNixCoyMn1-x-yO2三元材料的充、放电曲线图[31]
循环性能是判断一个锂离子电池正极材料优劣的重要标准之一。对于不同组分含量的NCM材料,在2.7~4.2 V(相对于Li+/Li)的范围内,材料中Ni含量的增加会导致容量的增加。Noh[32]等使用2032硬币型半电池来评价Li[NixCoyMnz]O2(x=1/3,0.5,0.6,0.7,0.8和0.85)的基本电化学性质,其中锂金属作为负极。图2-9显示了对于不同Ni含量的三元材料在3.0 V和4.3 V之间的恒定电流密度下的初始充、放电曲线,恒定电流密度为20 mA·g-1,倍率为0.1 C,温度为25 ℃。研究表明该电极的初始放电容量随着Ni含量(x)的增加而增加,因为Ni元素是充、放电过程中主要发生氧化还原反应的物质。当x=0.85,0.8,0.7,0.6,0.5和1/3时,材料的首次放电比容量分别为206 mAh·g-1,203 mAh·g-1,194 mAh·g-1,187 mAh·g-1,175 mAh·g-1和163 mAh·g-1。同时,为了确定Li[NixCoyMnz]O2电极的不同氧化还原行为,得到了带循环的充、放电曲线,相应的微分容量与电压曲线(dQ/dV)如图2-9(b)~(f)所示。图像表明在第一次循环中,Li[NixCoyMnz]O2(x=1/3)在充电和放电时分别表现出约3.76 V的氧化还原峰和3.72 V的氧化还原峰。但是随着Ni含量的增加,会出现新的氧化峰。此外,随着循环的进行,当Ni含量(x)增加,氧化还原峰变为更加极化的状态并且进一步分开。尤其是Li[NixCoyMnz]O2(x=0.8)电池在3.62 V处的氧化峰变小并且在100次循环后移动到3.76 V。说明随着镍含量的增加,其循环性能有所下降。
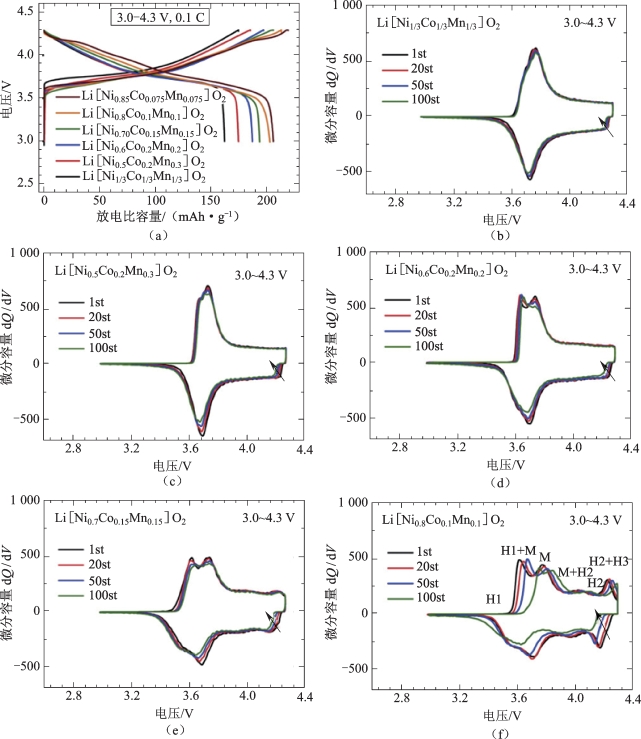
图2-9 Li/Li[NixCoyMnz]O2(x=1/3,0.5,0.6,0.7,0.8和0.85)的初始充电/放电曲线和相应的微分容量与电压曲线[32]
(a)初始充电/放电曲线;(b)x=1/3;(c)x=0.5;(d)x=0.6;(e)x=0.7;(f)x=0.8
图2-10说明了Li/Li[NixCoyMnz]O2(x=1/3,0.5,0.6,0.7,0.8和0.85)电池放电比容量与循环次数的关系,反应条件为25 ℃和55 ℃,电压为3.0~4.3 V,恒定电流密度为100 mA·g-1(0.5 C倍率)。由图得出,当x值分别为0.5,0.6,0.7和0.8时,材料的容量保持率分别为90.0%,85.1%,78.5%和70.2%,即材料中Li+的嵌入稳定性会随着Ni含量(x)的降低而增加,高镍材料比低镍材料稳定性更差,其容量衰减更快。Li[Ni 0.85 Co0.075 Mn0.075]O2的最高放电比容量为208 mAh·g-1,但在55 ℃下进行100次循环后,其容量迅速下降,容量保持率仅为55.6%(100 mAh·g-1),相比之下,低镍三元材料的Li+嵌入稳定性显著提高,容量保持率大于92.4%,在相同的循环周期和温度下仍保持150 mAh·g-1的放电比容量。普遍认为高镍三元材料Li+嵌入稳定性差是由于形成更稳定的尖晶石相[33]或稳定的LixNi1-xO相[34]导致循环时界面电阻的增加。
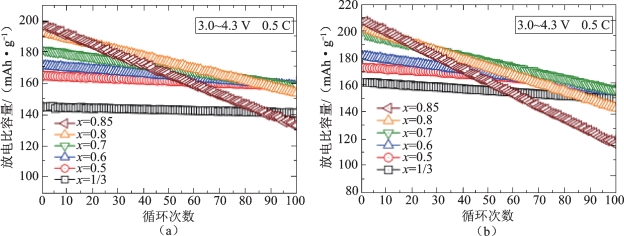
图2-10 25 ℃和55 ℃下Li/Li[NixCoyMnz]O2(x=1/3,0.5,0.6,0.7,0.8和0.85)电池的放电比容量与循环次数的关系[32]
(a)25 ℃时;(b)55 ℃时(https://www.daowen.com)
如图2-11所示,Ni含量为1/3的电池在测试中表现出最佳的容量保持率和热稳定性,安全性也最高。但是由于Ni含量最少,其放电容量受到限制。Ni含量最多的正极(x=0.85)容量衰减最为严重,热稳定性最差。容量衰减是由循环期间电极的总体积膨胀和表面结构降解,转变为尖晶石样结构造成的,这是高镍三元材料普遍存在的一个问题。
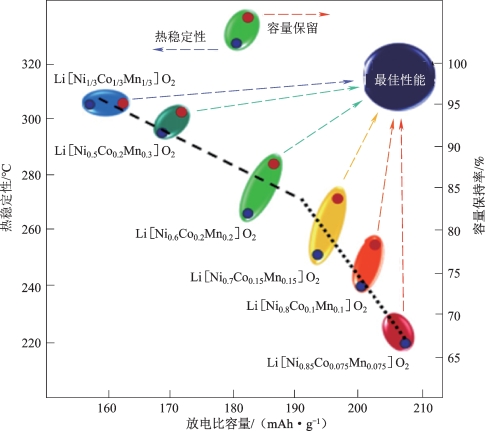
图2-11 放电比容量与三元材料的热稳定性和容量保持率之间的关系图[32]
Tian[35]等报道了一种高镍LiNi0.7Co0.15Mn0.15O2 正极材料,这种材料可以增强Li+的脱嵌/嵌入,从而产生优异的电化学性能。他们记录了第1、30、50和80次循环之后,材料在下截止电压为2.7 V,上截止电压分别为4.3 V,4.5 V,4.6 V,0.2 C时的充、放电电压曲线,如图2-12所示。由于循环期间结构变化会引起极化,该高镍正极材料的电压将降低。从图2-12(b)、(c)、(d)中看出,在较高的上限截止电压循环时,平均工作电压下降得更快,这进一步表明高充电电压将导致此材料严重的结构变化。但是与其他报道中的高镍材料相比,Tian等所制备的LiNi0.7Co0.15Mn0.15O2材料即使在高充电电压下也具有较好的循环性能,这是因为在循环过程中可以更容易地运输Li+。
在同一工作中,Tian等在电压为2.7~4.5 V,1 C的条件下测定了电池的倍率循环能力,如图2-13所示。从图中可以看出LiNi0.7Co0.15Mn0.15O2正极材料的初始放电比容量为175.1 mAh·g-1,库仑效率为81.9%。在100次循环后,放电比容量保持在147.8 mAh·g-1,且拥有84.4%的容量保持率。

图2-12 在不同的上限截止电压,0.2 C下制备的LiNi0.7Co0.15Mn0.15O2的循环性能和不同电位范围内的相应充电/放电曲线[35]
(a)典型循环性能曲线;(b)2.7~4.3 V;(c)2.7~4.5 V;(d)2.7~4.6 V
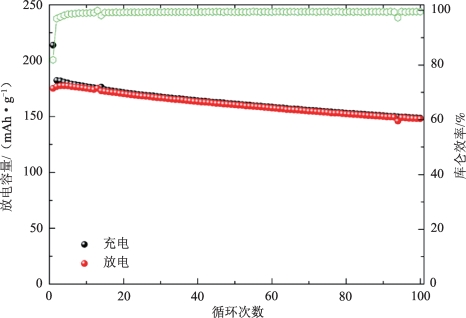
图2-13 所制备的LiNi0.7Co0.15Mn0.15O2的1 C充放电循环能力[35]
Tian等制备的LiNi0.7Co0.15Mn0.15O2材料具有稳定循环性能和高倍率性能以及充放电快速的优点,该材料有望应用于电动汽车和高功率存储。Lin等[36]对LiNi0.8Co0.1Mn0.1O2(NCM811)材料进行了电化学性能测试,测试条件:0.1 C倍率(1 C=275 mA·g-1),截止电压为4.5 V vs.Li/Li+。如图2-14所示,从图中可以看出该NCM811材料的初始放电比容量为215.6 mAh·g-1,伴随着电压衰减,材料在150次循环后容量只保留了最初的55.0%,见图2-14(b)。这种材料的容量衰减机制完全不同于LiNi1/3Co1/3Mn1/3O2(NCM333)材料,包括电化学过程中活性材料的结构和化学演变,但是关于这方面的研究还相对较少。
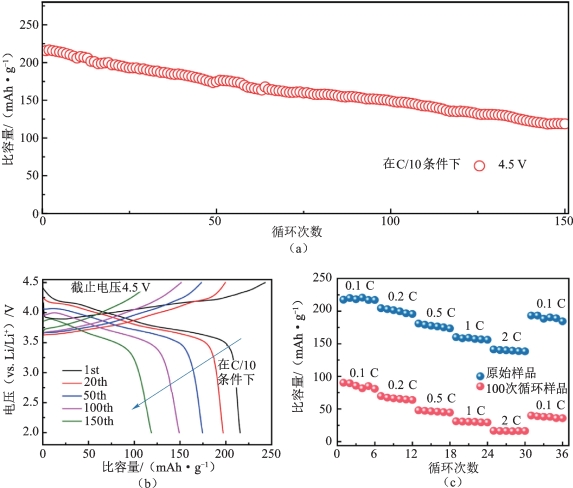
图2-14 截止电压为4.5 V(vs.Li/Li+),NMC811正极的电化学性能[36]
(a)0.1 C倍率的循环性能;(b)充电/放电电压曲线;(c)原始和100次循环样品的倍率性能
图2-14(c)中对比了NCM811在经历了100次循环前后倍率性能的差异。由图可见,在100次循环后,由于表面岩盐相中严重的反位缺陷,锂离子扩散通道被占据锂位的镍离子阻断,导致其动力学迟缓,倍率性能变差。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





