由于Ni元素成本低廉且毒性小于Co元素,因此LiNiO2曾被认为可能替代LiCoO2。LiNiO2的理论比容量为275 mAh·g-1,具有与 LiCoO2相同的层状结构,且在充、放电过程中经历着相同的结构转变。LiNiO2与LiCoO2均为α-NaFeO2型结构,属于六方晶系,空间群为R3m,晶胞参数为:a=0.287 8 nm,c=1.419 nm,比LiCoO2略大。LiNiO2的工作电压范围为2.5~4.2 V,自放电率低,对环境无污染,充、放电过程中可以有大约0.7个锂离子进行可逆脱嵌,实际比容量可达到190~200 mAh·g-1,远高于LiCoO2(实际比容量为140~150 mAh·g-1)材料,曾被认为是最有前途的正极材料之一。
在Li1-xNiO2脱锂的过程中,Li1-xNiO2经历着如图2-3所示的几段结构转变:(Ⅰ)x<0.25,Li1-xNiO2能维持斜方六面体晶型;(Ⅱ)0.25<x<0.55,结构转变为单斜晶型;(Ⅲ)0.55<x<0.75,结构再转变为六方晶型;(Ⅳ)0.75<x<1,Li1-xNiO2经历着两相反应,其实质是由于Ni3+离子的八面体位置稳定能量(OSSE)很低,Ni3+离子会向四面体位置迁移,材料发生不可逆相变,导致其层间距发生剧烈的变化,因而其容量保持率会急剧下降。因此,LiNiO2的脱锂量不应该大于0.75,其放电比容量也就不超过200 mAh·g-1[4]。
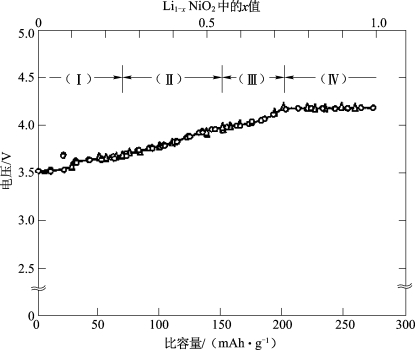
图2-3 Li1-xNiO2的开路电压曲线[4]
另外,LiNiO2还存在一些致命的缺点,限制了其进一步的发展与应用:(https://www.daowen.com)
(1)LiNiO2的热稳定性差,易于分解且产生大量的热,使得电池的安全稳定性较差;
(2)合成条件较为苛刻,制备工艺复杂,材料中Ni3+很容易被还原为Ni2+,需要严格控制煅烧的气氛和温度;
(3)容易发生阳离子混排现象,合成过程中生成的Ni2+的离子半径(rNi2+=0.068 nm)与Li+(rLi+=0.076 nm)的离子半径相近,Ni2+占据Li+的位置,妨碍了锂离子的扩散,从而影响材料的电化学活性。
研究发现,采用其他元素M(M=Al,Ti,Co,Mg,Mn等)替代LiNiO2中的一部分镍,可以降低阳离子混排现象,提高材料的结构稳定性,改善材料的电化学性能,因而衍生出后来的层状三元材料以及层状富锂材料。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




