1.实验目的
(1)了解贝洛索夫-恰鲍廷斯基(Belousov-Zhabotinsky)反应(简称BZ反应)的基本原理,掌握研究化学振荡反应的一般方法。
(2)掌握计算机在化学实验中的应用,测定振荡反应的诱导期与振荡周期,并求有关反应的表观活化能。
2.实验原理
化学振荡是一种周期性的化学现象。早在17世纪,波义耳就观察到磷放置在一瓶口松松塞住的烧瓶中时,会发生周期性的闪亮现象。1921年,勃雷(W.C.Bray)在一次偶然的机会发现H2O2与KIO3在硫酸稀溶液中反应时,释放出O2的速率以及I2的浓度会随时间周期变化。直到1959年,贝洛索夫首先观察到并随后为恰鲍廷斯基深入研究,丙二酸在溶有硫酸铈的酸性溶液中被溴酸钾氧化的反应,随后人们发现了一大批可呈现化学振荡现象的含溴酸盐的反应系统。人们统称这类反应为BZ反应。典型的BZ系统中,铈离子和溴离子浓摩的振荡曲线见图3-39。
图3-39 BZ反应中cCe4+/cCe3+和cBr-随时间的振荡
对于以BZ反应为代表的化学振荡现象,目前被普遍认同的是Field,Körös和Noyes在1972年提出的FKN机理,反应由三个主过程组成:
过程A
式中,HBr O2为中间体,过程特点是大量消耗Br-。反应中产生的HOBr能进一步反应,使有机物MA如丙二酸按下式被溴化为Br MA,
过程B
这是一个自催化过程,在Br-消耗到一定程度后,HBr O2才转到按以上两式进行反应,并使反应不断加速,与此同时,催化剂Ce3+氧化为Ce4+。(3)和(4)中,(3)的正反应是速率控制步骤。此外,HBrO2的累积还受到下面歧化反应的制约:
过程C MA和Br MA使Ce4+还原为Ce3+,并产生Br-(由Br MA)和其他产物。这一过程目前了解得还不够,反应可大致表达为
式中,f为系数,它是每两个Ce4+离子反应所产生的Br-数,随Br MA与MA参加反应的不同比例而异。过程C对化学振荡非常重要。如果只有A和B,那就是一般的自催化反应或时钟反应,进行一次就完成。正是由于过程C,以有机物MA的消耗为代价,重新得到Br-和Ce3+,反应得以重新启动,形成周期性的振荡。
文献中有时还写出“总反应”,例如丙二酸的BZ反应,MA为CH2(COOH),Br MA即BrCH(COOH)2,总反应为
它是由(1)+(2)+4×(3)+4×(4)+2×(5)+5×(A1)+5×(A2),再加上(6)的特例8Ce4++2BrCH(COOH)2+4H2O→8Ce3++2Br-+2HCOOH+4CO2+10H+组合而成。但这个反应式只是一种计量方程,并不反映实际的历程。
按在FKN机理的基础上建立的俄勒冈模型,可以导得振荡周期t振与过程C即反应步骤(6)的速率系数kc以及有机物的浓度cB呈反比关系,比例常数还与其他反应步骤的速率系数有关。如测定不同温度下的振荡周期t振,并近似地忽略比例常数随温度的变化,则可应用式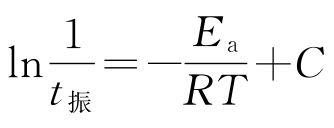 可以估算过程C即反应步骤(6)的表观活化能Ea。另外,随着反应的进行,cB逐渐减少,振荡周期将逐渐增大。
可以估算过程C即反应步骤(6)的表观活化能Ea。另外,随着反应的进行,cB逐渐减少,振荡周期将逐渐增大。
本实验采用电动势法测量反应过程中离子浓度的变化。以甘汞电极作为参比电极,用铂电极测定不同价位铈离子浓度的变化,用离子选择性溴电极测定溴离子浓度的变化。
BZ反应的催化剂除了用Ce3+/Ce4+外,还常用![]() (phen代表邻菲罗啉)。BZ反应除有上图示的典型的振荡曲线外,还有许多有趣的现象。如在培养皿中加入一定量的溴酸钾、溴化钾、硫酸、丙二酸,待有Br2产生并消失后,加入一定量的
(phen代表邻菲罗啉)。BZ反应除有上图示的典型的振荡曲线外,还有许多有趣的现象。如在培养皿中加入一定量的溴酸钾、溴化钾、硫酸、丙二酸,待有Br2产生并消失后,加入一定量的![]() (俗称亚铁灵试剂),半小时后红色溶液中会呈现蓝色靶环的图样。
(俗称亚铁灵试剂),半小时后红色溶液中会呈现蓝色靶环的图样。
3.仪器与试剂(www.daowen.com)
超级恒温槽1台;计算机1台;夹套反应器1个;电磁搅拌器1台;铂电极、溴离子选择性电极、双液接饱和甘汞电极各1支。
0.304mol·L-1CH2(COOH)2(丙二酸);1.52mol·L-1H2SO4(硫酸);0.252mol·L-1KBr O3(溴酸钾);0.024mol·L-1Ce(NH4)2(NO3)6(硝酸铈铵)。
4.实验步骤
(1)按装置图(见图3-40)接好线路。
图3-40 振荡反应装置图
1-溴离子选择性电极;2-甘汞电极;3-铂电极;4-恒温反应器;5-电磁搅拌器;6-实验监控仪和计算机
(2)先打开实验监控仪,再打开计算机,启动程序,在“项目管理”的菜单中选择打开“振荡反应”。选择“测量”,在“输出控制”的标签页中打开“温控开关”,然后在“温度控制”的模拟量输出框内输入所需的温度,并启动“输出”,然后打开恒温槽的水泵和加热开关,加热或恒温开始。
(3)分别取上述浓度的丙二酸、硝酸铈铵各10mL,硫酸、溴酸钾溶液各25mL于专用试管中,然后置于恒温槽中恒温。取去离子水25mL于反应器中。
(4)在“周期采样”的标签页中,设定采样周期为1s,采样时间设定为50min。在“同时测定参数”复选框中选中需要测定的参数。
(5)恒温10min后,将丙二酸、硫酸、溴酸钾溶液依次倒入反应器中,打开搅拌器,按下“周期采样”的标签页中的“开始采样”按钮,系统开始自动运行,同时开始计时,然后迅速将硝酸铈铵溶液倒入反应器。
(6)切换到“动态曲线”的标签页,电脑自动绘制动态曲线。记录t=0到出现转折曲线的时间为t诱。待出现3~4个峰时,用鼠标读出2个峰顶间隔的时间为t振,由几个峰顶间隔求出t振的平均值。(注意:显示动态曲线和温度时,鼠标在图形区域内,点右键选择“设置绘图范围”,可以改变坐标的范围和比例。如曲线不在图形区域内,右击选择“Y轴调零”即可。)
(7)待完成了一个反应温度曲线后,按下“周期采样”的标签页中的“停止采样”按钮,重新设置反应温度,重复步骤(3)~(7)测量。
5.数据处理
作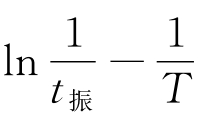 图,求出FKN机理中过程C即反应步骤(6)的表观活化能Ea。
图,求出FKN机理中过程C即反应步骤(6)的表观活化能Ea。
6.思考题
(1)为什么可用测定电池反应电动势的方法来测定BZ振荡反应的振荡曲线?
(2)为什么BZ振荡反应有诱导期?反应何时进入振荡期?
(3)系统中哪一步反应对振荡行为最为关键?为什么?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






