1.实验目的
(1)掌握用补偿法测定电池电动势的原理及电位差计的使用。
(2)掌握用电化学法测定化学反应ΔrHm、ΔrGm、ΔrSm的原理和方法。
(3)在不同温度下测定电池的电动势值,并计算该电池反应的ΔrGm和ΔrSm。
2.实验原理
在恒温、恒压只做电功的条件下,可逆电池反应的自由能变化值为
式中,nF为通过电池的法拉第电量数,n为电极反应中得失的电子数,F为法拉第常数。
根据Gibbs-Helmholtz方程式:
及恒温下焓的定义式:
将(3-4)、(3-5)式代入(3-6)式,即得
所以在定压下,由实验测得可逆电池在不同温度下的电动势,就可以求得该电池反应在各个温度下的ΔG、ΔS和ΔH。
本实验的电池反应式如下:
Zn(s)+![]() (0.2mol·dm-3)→
(0.2mol·dm-3)→![]() (0.2mol·dm-3)+Zn2+(1.0mol·dm-3)把反应设计成原电池:
(0.2mol·dm-3)+Zn2+(1.0mol·dm-3)把反应设计成原电池:
(—)Zn|Zn2+(1.0mol·dm-3)||![]() (0.1mol·dm-3)
(0.1mol·dm-3)![]() (0.1mol·dm-3)|Pt(+)根据式(3-5),在很小的温度区间内,可以认为ΔS与T无关,则积分式(3-5)得
(0.1mol·dm-3)|Pt(+)根据式(3-5),在很小的温度区间内,可以认为ΔS与T无关,则积分式(3-5)得
测定在不同温度下电池的电动势,可以求得电池电动势的温度系数 ![]() 从而得到ΔS,利用(3-4)、(3-6)式还可以求出各个实验温度时的ΔG,ΔH 值。
从而得到ΔS,利用(3-4)、(3-6)式还可以求出各个实验温度时的ΔG,ΔH 值。
为了在接近热力学可逆条件下测定电池的电动势,通常采用补偿法(详见仪器说明一),此时电路中用高灵敏检流计检测不出有电流通过,在这样的条件下,待测电池可认为是可逆工作的。
3.仪器与试剂
SDC-Ⅱ数字电位差综合测试仪1套;水浴恒温装置1套;U型管1支;Pt电极1支;锌电极1支。
1.0mol·dm-3ZnCl2;0.2mol·dm-3K3Fe(CN)6;0.2mol·dm-3K4Fe(CN)6;Hg(NO3)2饱和溶液KC1(A.R);王水;琼脂;00号砂纸。(https://www.daowen.com)
4.实验步骤
(1)盐桥的制备:将盛有3g琼脂和100mL蒸馏水的烧杯放在水浴上加热,直到溶解完全,加入10g KCl,充分搅拌,待KCl完全溶解后,趁热用滴管将此溶液装入原电池管底部的细管中。
(2)电极处理
A.锌电极的处理:用00号砂纸轻轻地把电极擦亮,用蒸馏水洗净后,插入Hg(NO3)2饱和溶液中3~4秒,取出后用滤纸擦拭锌电极,使锌电极表面上有一层均匀的汞齐,再用蒸馏水冲洗,用滤纸吸干插入电池中。(注意,用完的滤纸要回收,以免污染)。
B.铂电极的处理:把铂电极插入王水中,迅速取出用蒸馏水洗净,并用滤纸擦干。
C.原电池装置U型管两侧分别注入20mL1.0mol·dm-3ZnCl2溶液和10mL0.2mol·dm-3K3Fe(CN)6与10mL0.2mol·dm-3K4Fe(CN)6溶液,并分别插入处理好的锌电极和Pt电极。
D.按实验一接好水浴恒温装置。
E.按仪器说明一,接好补偿法测定原电池电动势线路。
F.将U型管放入水浴恒温槽恒温(每次恒温15min左右),第一次测量可控制恒温温度比室温高1℃~2℃,此后每次调温3℃,共测定5个温度,每个温度需测定5个数据,然后取平均值E。
5.数据处理
(1)将测定数据列表。
(2)以温度T为横坐标,电动势E为纵坐标,作E-T图求直线,求斜率 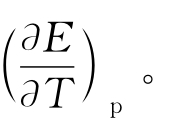
(3)求算电池反应在各个温度下及298K时的ΔG、ΔS及ΔH。
6.思考题
(1)根据补偿法测定原电池电动势的基本原理,叙述在实际操作中应注意的问题。
(2)试回答为何需在锌电极表面处理上一层均匀的汞齐?
(3)如使用UJ24电位差计,测量操作中,若发现检流计光标始终往同一方向偏移,试分析原因。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




