1.实验目的
(1)巩固溶解热的基本知识。
(2)测定硝酸钾的溶解热。
2.实验原理
晶体的溶解可分为两个过程:过程一是晶格的破坏,过程二是离子的溶剂化。例如:KNO3在水中溶解,在过程一中,晶体变成K+和NO-3;在过程二中,两种离子溶剂化。晶格的破坏是放热过程,离子的溶剂化是吸热过程,它们放热和吸热的代数和,决定了整个溶解过程是吸热还是放热。
溶解过程在等压条件下进行,ΔH=Qp。
溶解热分为积分溶解热和微分溶解热。积分溶解热指将1mol溶质溶于一定量溶剂,形成一定浓度的溶液时的热效应。微分溶解热指将1mol溶质溶于大量浓度一定的某溶液时的热效应。微分溶解热是一个偏微分量,可用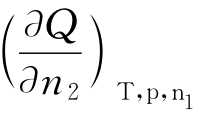 表示,其中n1为溶剂物质的量;n2为溶质物质的量。
表示,其中n1为溶剂物质的量;n2为溶质物质的量。
本实验中,KNO3的溶解是吸热过程,怎样测出它吸热的多少呢?KNO3溶解使系统温度下降,再通入电流,使系统温度回升,根据升温过程求出系统的热容。
式中,C为系统的热容;Q升为升温过程的热量;ΔT升为升温过程的温度变化;I为电流强度;U为电压;t为通电时间。
再用C求出降温过程中KNO3放出的热量,即积分溶解热。
如果ΔT降=ΔT升
做若干次实验,每次实验n1相同,n2不同,测出ΔHm,用![]() 表示浓度,作
表示浓度,作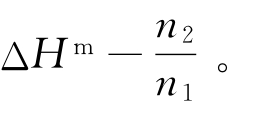 见图3-5为H2SO4在水中的积分溶解热,显然这是一个放热过程。由该图可以解决3个问题。
见图3-5为H2SO4在水中的积分溶解热,显然这是一个放热过程。由该图可以解决3个问题。
图3-5 H2SO4在水中的积分溶解热曲线
(1)求积分溶解热
如图3-5中,当把1mol溶质配制成浓度为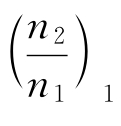 的溶液时,曲线对应的纵坐标为溶质的积分溶解热的负值-ΔHm,1。
的溶液时,曲线对应的纵坐标为溶质的积分溶解热的负值-ΔHm,1。
(2)求微分溶解热
如图3-5中,作切线。切线的斜率的负值为对应浓度时的微分溶解热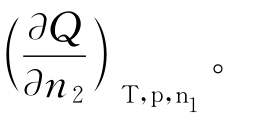
(3)求稀释热
把含有1mol溶质的溶液从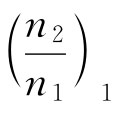 稀释到
稀释到 ![]() 时,稀释热ΔHm=ΔHm,2-ΔHm,1。
时,稀释热ΔHm=ΔHm,2-ΔHm,1。
3.仪器与试剂
仪器:SWC-RJ溶解热实验装置一套(见图3-6,也可用杜瓦瓶和贝克曼温度计等组装起来代替整套装置),称量瓶8个。(https://www.daowen.com)
试剂:干燥过的KNO3(分析纯)固体。
图3-6 SWC-RJ溶解热测定装置控制面板示意图
1-电源开关;2-串行口:计算机接口,根据需要与计算机连接;
3-状态转换键:测试与待机状态之间的转换;4-调速旋钮:调节磁力搅拌器的转速;
5-加热功率旋钮:根据需要调节所需输出加热的功率;6-正极接线柱:负载的正极接入处;
7-负极接线柱:负载的负极接入处;8-接地接线柱;
9-温度采零:在待机状态下,按下此键对温差进行清零;
10-测试指示灯:灯亮表明仪器处于测试工作状态;
11-待机指示灯:灯亮表明仪器处于待机工作状态;
12-计量显示窗口:当仪器进入测试状态时,计时器开始工作;
13-温度显示窗口:显示被测物的实际温度值;14-温差显示窗口:显示温差值;
15-加热功率显示窗口:显示输出的加热功率值;16-加料口;17-传感器插入口;
18-加热丝引出端;19-固定架:固定溶解热反应器
4.实验步骤
(1)开机,使仪器处于待机状态。
(2)将8个称量瓶编号,分别称取0.5g、1.5g、2.5g、3.0g、3.5g、4.0g、4.0g和4.5g KNO3,依次放入干燥器中待用。
(3)称取216.2g蒸馏水放入杜瓦瓶内,放入磁珠,拧紧瓶盖,放到反应架固定架上。将O形圈套入传感器,调节O形圈使传感器浸入蒸馏水约100mm,把传感器探头插入杜瓦瓶中,不要与瓶内壁相接触。
(4)按下“状态转换”键,使仪器处于工作状态。把功率调整到P≈2.5W,一边观察搅拌磁珠,一边调整转速,使转速符合实验要求。
(5)先让加热器正常加热,使温度高于环境温度0.5℃左右。按“温差采零”键,仪器自动清零,立刻打开杜瓦瓶的加料口,加入1号样品。如与电脑连接则可单击“开始绘图”,盖好加料口塞,观察温差的变化或软件界面显示的曲线,等温差值回到零时,完成第1次实验。加入2号样品,进行第2次实验,如此循环,完成8次实验。
如果手工画图,加料的同时,记录时间。
(6)第8次实验结束后,按“状态转换”键,使仪器处于“待机状态”。将“加热功率调节”旋钮和“调速”旋钮左旋到底,关闭电源,拆去实验装置。
5.数据记录与处理
(1)记录加热功率P,记录每一次实验后累计通电时间t。
(2)计算水的物质的量n1。计算每次加料后,累计硝酸钾物质的量n2。
(3)计算每一次实验后,累计硝酸钾溶解放出的热量Q和积分溶解热ΔHm,实验数据记录进表3-1中。
表3-1 数据记录
(4)作![]() 图。由图求
图。由图求![]() 分别为0.01和0.0025时的积分溶解热ΔHm,求
分别为0.01和0.0025时的积分溶解热ΔHm,求![]() 在0.01~0.0025时的稀释热ΔHm。
在0.01~0.0025时的稀释热ΔHm。
6.思考题
(1)微分溶解热和积分溶解热有何区别?
(2)温度和浓度对溶解热有什么影响?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








