绒毛膜羊膜炎(chorioamnionitis,CAM)是病原微生物感染所致的炎症性疾病。羊膜和绒毛膜的组织病理改变是诊断CAM的金标准,这种炎症最常见的结果是羊水、胎膜、胎盘和(或)子宫的感染。这些感染在常用的医学文献中也被称为羊膜腔感染综合征(intra-amniotic infection syndrome,IAIS)、宫腔内感染(intrauterine infection)、羊膜感染(amnionitis)等。
一般很难得到CAM的准确发病率。妇产科教科书通常认为CAM的发生率为1%左右。这可能是比较保守的数字。在发展中国家,妇女在妊娠期间因为不能得到理想的产前保健和充足的营养,CAM发生率可能更高。CAM中约有12.5%表现为临床CAM,其余均为亚临床感染。Lopez-Bernal等发现亚临床CAM占自发性早产的40%。
虽然CAM造成孕产妇死亡十分罕见,但与CAM直接相关的早产儿死亡率却在10%以上。此外,现在认为,CAM是胎膜早破性早产和(或)自发性早产的原因,是早产最常见的原因。因为CAM①一旦发病,短期内将早产;②可导致超低体重儿出生;③是胎儿感染和胎儿炎症反应综合征(fetal inflammatory response syndrome,FIRS)的原因,导致胎儿预后极为不良,所以CAM是产科临床中重要的疾患。
CAM主要的感染途径是阴道细菌上行感染,可从无症状到出现明显临床表现,如孕妇体温超过38℃、心动过速(≥100/min)、子宫压痛、化脓或恶臭的羊水、白细胞计数增高(>15×109/L)及胎儿心动过速(≥160/min)等。一旦出现上述的表现,早产不能避免。
现在有各种生物化学的炎症标志物可用于早期诊断CAM。因此:①如有可能去除CAM的危险因素,则可能预防临床CAM的发生,从而预防早产;②如能早期诊断、治疗,可能继续维持妊娠和改善胎儿、新生儿的预后;③对于重度CAM的及时诊断和治疗可以明显减少母儿并发症的发生。
(一)CAM引发早产的机制
1.CAM的感染途径 CAM最常见的感染途径是下生殖道的细菌上行感染(图1-4)。上行性感染分为四期。Ⅰ期包括阴道或宫颈微生物群的改变或宫颈内存在病原微生物如淋病奈瑟菌。某些需氧菌感染引起的阴道炎可能是该期的早期表现。一旦致病菌进入宫腔,就会在蜕膜组织中定殖(Ⅱ期)。局部炎症可能先引起蜕膜炎,然后是绒毛膜炎的发生。这时病原微生物将在绒毛膜及羊膜中定殖。感染将有可能侵入胎儿血循环(绒毛膜脉管炎)。也可能穿透羊膜(羊膜炎)进入羊膜腔(Ⅲ期),即羊水感染,这一期胎儿感染及FIRS患病率高,必须尽快娩出胎儿。由于病原微生物具有穿透完整羊膜囊的能力,因而羊膜破裂并不是发生羊水感染的必要条件。一旦病原微生物进入羊膜腔就可能通过多种途径感染胎儿(Ⅳ期)。
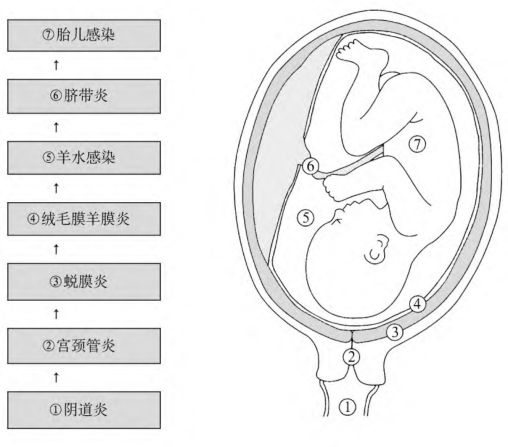
图1-4 上行性感染的发生过程
其他感染途径包括血行感染、经胎盘感染、盆腔感染扩散和医疗操作过程中发生的宫内感染,如羊膜腔穿刺和绒毛活检,虽相当少见,但也有发生。也有学者认为妊娠前即存在慢性子宫内膜炎,子宫内潜伏的病原微生物在妊娠后密闭的子宫内增殖,引发炎症。除病原微生物感染外,CAM还包括绒毛膜下血肿等非感染性炎症。
2.引起CAM的病原微生物 病原微生物通常是厌氧菌和需氧菌的混合多重感染。从早产伴胎膜完整的孕妇的羊膜腔中发现,最为常见的微生物有以下几种:解脲支原体、梭形杆菌以及人型支原体。在胎膜早破的病例中,解脲支原体侵入羊膜腔可能导致胎儿、羊膜囊及母体子宫严重的炎症反应。解脲支原体可能同CAM、产后子宫内膜炎、术后伤口感染、新生儿败血症、脑膜炎以及肺支气管发育不良等疾病的发生有关。从羊水中分离的病原体还包括无乳链球菌、消化链球菌、金黄色葡萄球菌、阴道加德纳菌、草绿色链球菌和类杆菌属。偶尔也会检测到乳酸杆菌、大肠埃希菌、粪肠球菌、奈瑟菌和消化球菌。而流感嗜血杆菌、噬碳酸菌、口腔球菌、梭状芽胞杆菌等相当少见。其中B族链球菌是引起新生儿肺炎、败血症的主要致病菌。半数以上的感染病例从羊膜腔中分离出的病原微生物不止一种,其病原体类型与宫颈、阴道内病原体类型相似,提示下生殖道感染与上行性的CAM有关。近年来性传播疾病、TROCH、B19微小病毒及肝炎病毒等引起的CAM也逐步受到重视。
3.CAM引发早产的机制
(1)诱发宫缩:CAM时可通过以下途径诱发宫缩。
①内毒素。一旦细菌定殖在宫腔内,其不仅感染胎儿,也释放内毒素。细菌内毒素是革兰阴性细菌细胞壁的主要成分,又称为脂多糖(LPS),为细菌的主要毒性成分,通常在细菌死亡裂解或用人工方法破坏菌体后才释放出来,对机体具有广泛的生物学作用。有实验表明LPS可能通过刺激巨噬细胞、羊膜、蜕膜,通过内源性的PG产生、释放和激活L-型钙通道,增加钙内流这两条途径加大孕鼠子宫的敏感性,引起子宫收缩的自发性、节律性和收缩幅度增加。Romero等报道264例早产患者羊水中内毒素阳性者有13例,占4.9%,该13例均发生早产分娩。内毒素是早产分娩的启动因子。除细菌外,螺旋体、衣原体、支原体和立克次体亦有类似的内毒素物质。革兰阳性细菌感染产物中的肽聚糖也与PG产生有关,由PG进而引发分娩启动。
②细胞因子。各种炎症最终激活蜕膜-羊膜的细胞因子网络系统,包括IL-1β、TNF-α、IL-6、IL-8以及G-CSF产生,连锁效应导致更多细胞因子释放,白细胞迁移,继而导致局部蛋白酶及胶原酶增加,使前列腺素释放更多。因局部PG含量明显升高,高浓度PG导致子宫收缩,导致早产。
③胎儿宫内缺氧。CAM除感染本身可激活蜕膜外,感染还可能引起胎儿宫内缺氧或产生有毒物质刺激胎儿,使胎儿发放临产信号,共同激活蜕膜,局部出现高浓度PG,促使子宫收缩。子宫下段、宫颈扩张和胎先露的机械性刺激又反射性引起垂体释放催产素。PG和催产素共同作用于子宫,完成早产分娩。
④凝血酶。Darby等发现亚临床CAM和脐带炎症的早产者中,胎盘早剥的发生率为41%,而因其他并发症需终止妊娠的早产患者胎盘早剥发生率为4%,前者显著高于后者,提示亚临床感染可能通过引起胎盘早剥造成早产。蜕膜血肿的出现导致局部产生凝血酶,最近的研究显示凝血酶在促进血液凝固的同时也活化IL-8等趋化因子和诱导炎性细胞因子。由此可以通过PG等途径诱发宫缩。临床上,只有溢出血管的血液才能产生凝血酶。(www.daowen.com)
(2)促进宫颈成熟:CAM时可以通过以下途径促进宫颈成熟。
①PG。PGF2α能增加氨基葡聚糖活性及氨基葡聚糖中的透明质酸成分,后者有助于松解宫颈胶原网状结构。PGE2可使基质细胞脱颗粒,释放结缔组织酶使宫颈成熟、软化。PGI2能抑制胶原纤维合成,促进氨基葡聚糖合成,且能使宫颈胶原纤维裂解,使组织间隙扩大,从而使宫颈管在开大过程中,增强组织伸展性。
②硝酸盐和亚硝酸盐:硝酸盐和亚硝酸盐是NO的活性代谢产物,炎症时增高。过度合成的NO,可激活MMPs,MMPs与胶原分解代谢有关,促使细胞凋亡而导致宫颈扩张。MMPs在早产预测方面的敏感性及临床可信度正在研究中。
③酶。妊娠期子宫状态分4期:静息期、激活期、兴奋期和复旧期。足月前发生的CAM可导致子宫蜕膜、宫颈管发生中性粒细胞和巨噬细胞的趋化和浸润,并释放水解酶,引起胶原组织的降解,促进宫颈成熟及绒毛蜕膜间的松动,使子宫提前由静息期向激活期转变。
(3)胎膜早破:细胞因子使白细胞释放蛋白分解酶及弹性蛋白酶,分解细胞外基质。巨噬细胞释放胶原分解酶使胎膜上的Ⅲ型胶原分解,胎膜变得脆弱,加上炎症刺激前列腺素产生增多而发生子宫收缩,容易导致胎膜早破,早产发生。
因此认为CAM是导致早产的直接原因。图1-5简单地阐述了CAM与胎膜早破、早产及母儿并发症之间的关系。
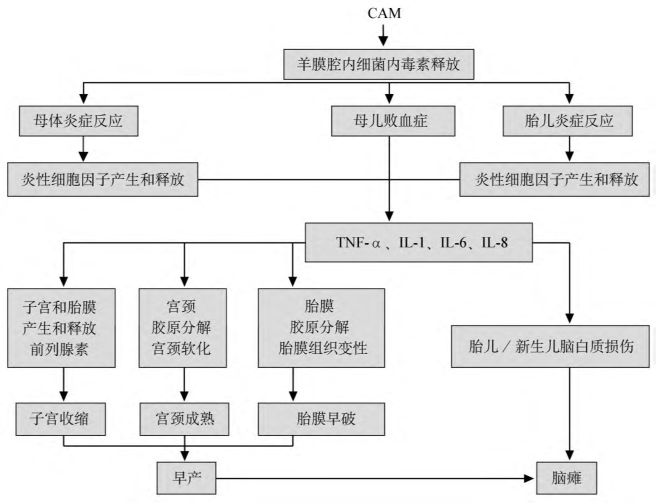
图1-5 CAM与早产的发病机制
(二)CAM与早产的关系
1.早产的主要原因与CAM 早产的三大主要原因是CAM,胎膜早破和宫颈机能不全。这三大原因单独或合并存在都可引起早产。CAM是胎膜早破的原因,胎膜早破后可发生CAM。宫颈机能不全时局部的炎症也容易导致上行感染,因而这三大因素相互关联,成为早产的三大原因。其中CAM是引起早产因素中发生频率最高的。今井等报道103例妊娠22~36周早产、流产病例(除外多胎及人工流产),分娩时取胎膜组织检查发现约67.3%诊断CAM,其中31.9%为绒毛膜感染,22.1%为羊膜感染,考虑20%~50%的CAM与早产直接相关。
2.早产周数与CAM的关系 早产的妊娠周数越小,与CAM的关系越密切。平野等报道早产和流产病例中Ⅲ期CAM(羊水感染)的发生率在妊娠22~25周为59.1%,妊娠26~29周为34.0%,妊娠33~33周为7.9%,妊娠34周以后下降为0考虑早期早产和流产的原因与CAM有关。
(三)CAM的母体并发症
大约有15%的CAM孕妇发展为菌血症。其他的母体并发症包括产程异常增加、缩宫素的应用增加、剖宫产率增加、产后出血及外科并发症如伤口感染、盆腔感染及产后子宫内膜炎也增加。但因为广谱抗生素的应用及有效的医疗护理,CAM很少产生危及孕妇生命的并发症,如感染性休克及呼吸窘迫综合征。
(四)CAM的胎儿、新生儿并发症
CAM对胎儿及新生儿危害很明显,包括败血症、肺炎、呼吸窘迫综合征和死亡,这些并发症的发生随着孕周的下降而急剧升高。此外,CAM与婴儿长期神经功能损害有关,尤其应注意到无论是足月儿还是早产儿,CAM都增加囊性脑室周围白质软化症(PVL)和脑瘫(CP)的风险。胎儿脑白质的损害或软化可导致新生儿运动障碍或脑瘫。早期的相关性研究提示CAM使CP的风险增加了5倍。2000年的一份30项研究的荟萃分析报道了临床CAM与早产儿PVL的相关性(RR:3.0,95%可信区间为2.2~4.0),与早产儿脑瘫的相关性(RR:1.9,95%可信区间:1.4~2.5),而且发现临床CAM与足月儿CP(RR:4.7,95%可信区间:1.3~16.2)呈正相关。值得注意的是这项研究还发现不仅临床CAM升高了PVL和CP的危险,而且组织学CAM(静止型或亚临床型感染)也增加了这种风险。较新的研究支持上述结论,并发现无论对早产儿还是足月儿,CAM均是脑瘫的独立危险因子。CAM导致胎儿、新生儿神经损伤的机制与其导致胎膜早破的机制类似,如图1-3所概述。胎儿如同母亲一样对CAM产生炎症反应,胎儿似乎特别“旺盛”地产生细胞因子(IL-1、IL-6、TNF-α)。据认为,这些细胞因子与胎儿大脑白质坏死及长期的神经系统后遗症,包括脑瘫有关。Gomez等描述了这种“炎症反应综合征(FIRS)”,并指出胎儿血浆中IL-6>11pg/ml是新生儿死亡和早产的独立预测因子。
现在还不清楚为什么只有部分CAM的胎儿有永久性的神经后遗症,细胞因子导致脑白质损伤的确切机制也尚未能充分阐明。有可能是胎儿炎症反应释放的一些细胞因子触发了其他炎症因子的产生,后者可直接损伤细胞;也可能是由于细胞因子所导致的炎症损害了胎盘循环,导致或加剧了胎儿的缺氧性损伤。Yoon等所做的工作表明遗传易感性可能决定了胎儿炎症反应的强度,与脑瘫有关的CAM可能通过多种途径起作用,其中包括遗传学。更重要的是这种胎儿炎症反应综合征和随后的胎儿脑组织损害可能发生在产前及母亲出现临床症状以前,且伴有胎儿炎症反应综合征者比仅有母体炎症反应的CAM的婴儿有更高的非神经系统并发症所致的死亡率和发病率。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







