传统上把早产预想为单一的病理过程,并给予千篇一律的治疗。现在已经清楚地认识到根据孕龄不同,早产的主要病因是不同的,涉及到全身和宫内感染(绝大部分极早早产)、精神紧张、子宫胎盘血栓和与胎儿应激及蜕膜出血有关的宫内血管病变、子宫过度膨胀、宫颈机能不全等。表1-6显示目前普遍承认的早产病因和导致早产的路径。
表1-6 普遍承认的早产病因和导致早产的路径

以上每一个路径均可受基因及环境因素的影响。对于辅助生育(ART)病人,这些途径和相关的作用可能不同。在ART病人中,导致早产的病因是多因素的,除了多胎妊娠所造成的子宫过度膨胀外很少为人所理解。尽管病因和启动途径不同,但强有力的证据表明,早产和足月分娩有许多共同路径,包括胎儿HPA轴的激活(胎儿成熟、感染或缺血所致),此外也包括内分泌、旁分泌和免疫系统的相互作用,激活共同的下游细胞和效应分子。通常导致早产分娩的一系列路径如图1-3所示。尽管早产的病因是多方面的,但早产有许多独特的上游调节启动因子,而导致早产的下游效应因子较少,包括前列腺素、基质金属蛋白酶和催产素。
(一)精神紧张导致早产的机制
精神紧张逐渐被认为是早产分娩的一个重要的危险因素。在这里精神紧张可以被简单地认为是来自心理或是生理上的挑战,这种挑战可以威胁到内环境的稳定。把母体心理压力和早产联系到一起的流行病学证据表明通过神经内分泌、免疫、炎症、行为过程这几个通路能够把母体心理压力和早产联系到一起(图1-3)。
1.神经内分泌过程 把精神紧张和早产联系到一起的神经内分泌过程受胎盘CRH的介导。因精神紧张而产生的所有主要生物活性物质包括皮质醇、儿茶酚胺、缩宫素、血管紧张素-2及IL-1等,对胎盘CRH的生成都有影响,呈剂量-效应关系。体外研究也发现母体心理压力和母体血浆内的CRH、ACTH和皮质醇的水平密切相关。好几项研究均把母体血浆内CRH的早期增长和分娩时间联系到一起,Hobel等对整个怀孕过程进行了一系列的CRH水平检测,发现早产妇女的CRH水平要比足月分娩妇女显著提高,并且呈加速增长。除此以外,他们还发现孕中期母体心理压力水平预示孕中期以后的母体CRH水平会大幅度增长。
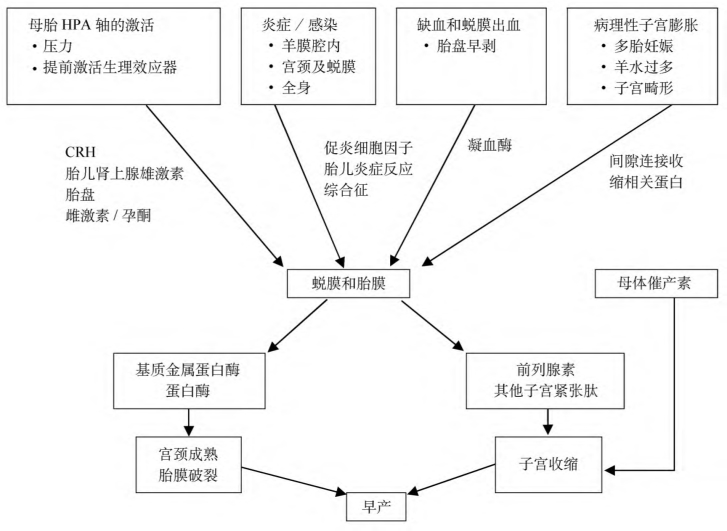
图1-3 引发早产的共同路径
这些数据暗示母体心理压力和早产之间的关系可能是由胎盘CRH的表达不断升高所介导的。在足月分娩时,由于胎儿成熟,胎盘CRH的激活主要是由胎儿HPA轴以正反馈的形式来驱动。在早产分娩时,也许是母体HPA轴驱动胎盘CRH的表达。母体精神紧张导致包括皮质醇和肾上腺素在内的生物活性物质水平不断升高,从而激活胎盘CRH基因的表达。胎盘CRH进而刺激胎儿分泌皮质醇和DHAS(被胎儿HPA轴激活)和胎盘释放雌三醇、前列腺素,促使早产发生。
2.免疫和炎症过程 精神紧张也能改变免疫功能的神经内分泌调节,导致羊膜腔感染或炎症的易感性增加。HPA轴和免疫系统间存在着广泛的内部联系。在生理条件下,HPA轴抑制了机体的免疫炎症反应,在HPA轴和免疫系统间存在负反馈:促炎细胞因子(如IL-1β、TNF-α和IL-6)刺激了HPA轴,导致了糖皮质激素的分泌,糖皮质激素依次下调促炎细胞因子并抑制炎症反应的其他方面。
在急性应激的情况下,糖皮质激素主要抑制炎症反应;但对于反复的和慢性应激,糖皮质激素可以增强炎症反应,包括促进炎细胞因子的表达。在面临生活压力的观察对象中,发现促炎细胞因子和Th1细胞因子的过度分泌,这一免疫激活与特定的和非特定的细胞免疫反应有关。这些细胞因子能下调糖皮质激素受体,减少糖皮质激素受体的亲和力。有证据表明这一免疫激活的循环,加上HPA轴对细胞因子分泌的不充分限制,是炎性疾病进展的主要部分。因此,反复的和慢性的应激可以导致促炎症反应和Th1细胞因子的表达失调,从而为了对压力和感染做出反应,过度激活炎症反应。但这些机制还需要更加深入的研究。
3.行为过程 压力也许可以诱发母体的危险行为,以作为处理应激的一种方法。行为过程可由神经介质的变化来调控。在动物研究中,CRH和相关的神经肽在调节运动和心理活动,躲避刺激和识别暴露于有害刺激中扮演中心角色。CRH也可以部分调节可卡因成瘾的神经内分泌和行为影响。在恒河猴,机体对刺激的高活动性反应与依赖CRH的HPA轴的波动性变化之间有明显相关性。在老鼠下丘脑中和下丘脑外边缘中,可卡因的快速使用可诱发CRH浓度改变并与剂量和时间呈依赖关系。可卡因撤退后可引发焦虑样行为表现及下丘脑、扁桃体、基底前脑中CRH浓度的改变。
尽管在动物研究中我们收集了数据,但是在人类研究中,压力是否会增加母体风险行为这一问题还未清晰地阐明。尽管少数临床基础研究发现,机体对刺激的反应在母体心理压力和较低的出生体重间起着介导作用,但大多数研究只把机体对刺激的反应视为混淆因子。
近期的人群研究发现,尽管生活压力事件与早产并不显著相关,但母体生活压力事件与孕期吸雪茄和较晚的产前保健显著相关。
(二)子宫过度膨胀导致早产的机制
子宫过度膨胀在与多胎妊娠、羊水过多、巨大胎儿有关的早产发动中起着关键作用。子宫过度膨胀引发早产的机制还不很清楚。可能为子宫伸展引发间隙连接蛋白(诸如CX-43和CX-26)的表达,以及其他的收缩相关蛋白(诸如催产素受体)表达。在体外实验中,子宫肌层的伸展使PGHS-2和PGE增加。子宫下段肌肉的伸展可以使IL-8和胶原酶的水平升高,促进宫颈成熟。子宫伸展引发的PGHS-2和IL-8的表达增长是由丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)系统的激活来调节的。在子宫激活过程中,存在着机械和内分泌信号的相互作用。体外研究发现,对切除卵巢的老鼠子宫机械牵拉时,CX-43的表达水平不断增长,这一作用可以被孕酮阻止。与之相似的是,老鼠妊娠中期高水平的孕酮使其子宫伸展不会影响子宫CX-43的表达而分娩发动前的孕酮撤退允许CX-43的表达。
子宫伸展对于子宫表达G蛋白的影响还不清楚。人类子宫过度膨胀的研究比较缺乏。最近的一项研究发现,经历足月剖宫产分娩的非临产妇女子宫内,Gsα、PGE2受体、CX-43和CX-26表达水平在单胎和多胎妊娠间无差异。而且,体外机械拉伸并不会改变Gsα的表达水平,Gsα的表达并不受与压力有关的生物活性物质的影响。这些研究表明子宫伸展促进人类子宫收缩的机制是复杂的,也可能包括其他的因素;没有造成早产的多胎妊娠可能对子宫不断伸展存在着代偿机制,预防异常的CAPS表达。
(三)子宫胎盘血栓形成和蜕膜出血导致早产的机制
胎盘血管病变的特点是螺旋动脉的生理转化失败、动脉粥样硬化、母体或胎儿动脉的血栓形成,通常与早产和早产胎膜早破(PPROM)有关。34%的早产妇女及35%的PPROM妇女有胎盘血管病变,而没有并发症的足月分娩只有12%。
胎盘血管病变导致早产可能与子宫胎盘缺血有关。尽管具体病理生理学机制未明,但通常认为凝血酶在其中起关键作用。
凝血酶是一种多功能蛋白酶,除了凝血作用外,可引发血管、子宫、大肠平滑肌的收缩。凝血酶激活一组特异的受体,其中包括蛋白酶激活受体1、3和4。这些跨膜受体是具有七螺旋跨膜域的G蛋白耦联超家族的成员,在与凝血酶相互作用中发生构象改变,耦联G蛋白,激活磷脂酶C。磷脂酶C的激活发动了生物化学反应,导致细胞内钙从粗面内质网的释放和细胞外钙的流入,导致细胞质中钙离子水平升高,激活钙调蛋白、肌球蛋白轻链激酶(MLCK)、肌动蛋白及肌球蛋白,导致子宫收缩。凝血酶通过这些细胞内信号活动作为一个经典的子宫收缩激动剂发挥作用。
体外研究显示凝血酶的刺激使纵向平滑肌的肌张力和收缩均加强,呈剂量依赖方式。最近,在体内模型中应用凝血酶、全血和凝血酶抑制药证实了这些体外研究结果。凝血酶和全血均以剂量依赖的方式促进子宫收缩。但是,加入肝素(已知的凝血酶抑制药)后,子宫收缩明显减弱。临床上观察到胎盘早剥和继发于妊娠早期和中期出血的早产患者中存在子宫活动增多可能是由上述原因所致。
凝血酶和PPROM间也可能存在某种联系。在体外,凝血酶可使从无并发症的足月妊娠收集来的胎膜和蜕膜细胞的MMP-1、MMP-3和MMP-9蛋白表达水平显著增加。而MMPs可降解羊膜、绒毛膜和蜕膜的细胞外基质,并导致PPROM。凝血酶也引起蜕膜中IL-8以剂量依赖方式增长,IL-8是负责募集中性粒细胞化学趋动的细胞因子。胎盘早剥是蜕膜出血的一个例子,也是与中性粒细胞大量地渗入蜕膜有关的一个例子,而中性粒细胞是蛋白酶和基质金属蛋白酶的丰富来源。这也许说明了在蜕膜出血情况下胎膜早破的机制。然而,在人体中证实这些体外观察结论是很困难的,主要是因为直接测量凝血酶的水平非常困难。通常测量凝血酶-抗凝血酶Ⅲ(thrombin-antithrombinⅢ,TAT)复合物水平来间接地测量凝血酶的活性。在妊娠妇女,整个孕期中TAT水平逐渐增长,TAT水平随着分娩进程持续增长,在胎盘娩出时达到高峰。在一组前瞻性的队列研究中发现入院3周内分娩的早产孕妇与对照组妇女相比,TAT水平显著提高,ROC曲线分析表明,TAT水平>8.0ng/ml预测早产的敏感性为50%,特异性为91%,阳性预测值为80%,阴性预测值为71%。在一组病例对照研究中,通过检测妊娠中晚期PPROM妇女血浆样本,探讨升高的TAT水平和PPROM间的联系,发现在妊娠中晚期,与没有PPROM的足月妊娠妇女相比,PPROM妇女血浆中TAT水平显著增长。这些研究使得以下的假设更加可信:自发性早产或PPROM中有很大部分是由亚临床蜕膜出血造成的。凝血酶在子宫收缩和胎膜降解中发挥重要作用的共识有助于解释阴道出血、胎盘后血肿和早产之间的关系。
(四)感染导致早产的机制
生殖道感染与早产密切相关。这些感染通常是指起源于下生殖道的上行细菌感染,病毒感染不被认为是早产显著的病因。与早产有关的感染源包括宫内感染、下生殖道感染、母体全身感染、无症状性菌尿和牙周炎。(www.daowen.com)
宫内感染被认为是早产最重要的和可预防的潜在病因之一。孕28周前的早产50%以上是由宫内感染引起的,而且早产儿死亡率和发病率均较高。孕30周前自发性早产妇女的绒毛膜和羊膜中有73%存在微生物侵入,而在没有临产的医源性早产中这种概率只有16%。60%的早产患者有绒毛膜和羊膜的微生物感染。对有明确羊水感染的大部分早产患者来说,标准的保胎治疗很难奏效。
现有大量证据表明,促炎细胞因子-前列腺素级联在感染有关的早产的病理机制中发挥重要作用。这些炎症介质由巨噬细胞、蜕膜细胞和胎膜在受细菌和细菌产物刺激时产生。早产中促炎细胞因子的作用基于以下观察:在羊膜腔内感染和早产患者羊水中细胞因子及前列腺素的浓度升高;在体外,细菌产物刺激人类蜕膜产生促炎细胞因子,这些细胞因子又刺激羊膜及蜕膜产生前列腺素;IL-1应用于怀孕老鼠或者是灵长类动物可引发早产,这类早产可以应用IL-1受体拮抗蛋白来预防。
宫内感染导致早产的另外一个代偿机制是胎儿HPA轴的激活。在伴有宫内感染的妇女和实验性羊膜腔感染的非人类灵长类动物中发现胎儿皮质醇和肾上腺雄激素水平的升高。Gravett等证明在灵长类动物中,B族链球菌实验性宫内感染后子宫收缩增强之前的24~48h,羊水中促炎细胞因子(IL-1β、TNF-α、IL-6和IL-8)、前列腺素和MMPs依次升高,导致早产。这一模型说明了感染、炎症和分娩三者之间的时间性关系。Hirsch和Wang对击昏后的老鼠做的补充性工作证实,IL-6既不是有一个必要的也不是必需的刺激早产的级联成分,而IL-1β是必需的。
以上观察暗示与早产有关的感染是临近早产分娩发生的急性事件。然而,近期证据显示妊娠中期羊水中解脲支原体感染可以造成滞后好几周的早产。尽管有最强有力的证据显示宫内感染与早产有关,但相当多的证据也表明下生殖道感染,尤其是细菌性阴道病,也可导致早产。细菌性阴道病与早产、羊水感染、绒毛膜羊膜炎和产后子宫内膜炎有关。这些关系被广泛的评论,基于病例对照研究和队列研究已经发现在细菌性阴道病的妇女早产率呈双倍增长;在胎膜完整的早产和亚临床羊水感染,30%妇女羊水中的微生物与细菌性阴道病相关;临床症状明显的羊水感染妇女、早产或是组织学绒毛膜羊膜炎妇女羊水中与细菌性阴道病相关的微生物更多。
尽管在这些研究中指出细菌性阴道病增加早产的危险性不大,但是孕期细菌性阴道病的高发(20%)使其对于早产的总体影响越来越大。6%的低出生体重早产儿可以归因于细菌性阴道病。因此,细菌性阴道病代表了一个重要的和潜在的可预防的早产病因。然而,在孕期对细菌性阴道病进行的药物治疗得出了矛盾的结果。虽然多项研究表明,在有早产风险的妇女当中进行细菌性阴道病的抗生素治疗会减少早产和流产的发生率,并消除细菌性阴道病。但是有的研究没有发现类似结果。近期的一项关于细菌性阴道病抗生素治疗试验的荟萃分析显示早产和妊娠死亡率并没有持续降低,部分是由于数据的不一致性所致。
早产也与母体全身感染有关(很大程度上归因于母体疾病的严重程度)。牙周病是口腔厌氧菌感染,影响到50%以上的人群,包括孕妇。母体牙周病与好几种不良妊娠结局有关,包括早产、先兆子痫和流产。最近包含25项研究的综述中,18项证明牙周病和不良妊娠结局有联系,早产或是低出生体重的OR值为1.1~20。而且,三项牙周治疗的临床实验表明,早产的风险减少了50%。与牙周病有关的早产机制没有被彻底的阐明。对家兔进行的研究实验数据暗示,与牙周炎有关的口腔病原体能进入循环系统,能在羊水中发现,胎盘中也发现了病原体的DNA。另外,与牙周炎有关的革兰阴性厌氧菌可以是脂多糖内毒素的来源,增加促炎症介质的水平,包括细胞因子和前列腺素。
感染相关的早产中难以回答的问题是:患有下生殖道感染、全身感染或牙周病的绝大多数妇女并没有早产。因此,宿主对潜在的病原体的炎症反应在早产中发挥重要作用。细胞因子(和一些Toll样受体)在遗传上是多形性的。炎症反应中的遗传差别在决定是否会发生早产上扮演主要角色。
(五)植入错误导致早产的机制
传统上讲,早产被认为是分娩发动的结果。在妊娠中期以前与早产有关的CRH水平提高表明,触发早产的因素可能在分娩前已经存在,而且比以前预想的时间还要早。越来越多的证据表明,妊娠并发症包括早产只在妊娠中后期才明显表现出来,实际上早在胎盘发育前从胚泡植入宫腔开始可能就存在问题。植入问题和自发性早产之间直接的因果关系在动物或者是人类研究中并没有建立起来;但是,间接的证据表明这也许是进一步研究的重要领域。未怀孕的宫腔通常寄居着微生物,亚临床子宫内膜感染或炎症可以对植入和胎盘形成造成损害,也许引出抗滋养层免疫反应,造成凋亡,减少滋养层入侵和蜕膜及子宫动脉的重建,早期胚胎发育停止。植入期前后的子宫内膜炎症反应可能导致早产。进一步来说,正常妊娠的特点是,从促炎症Th1型反应转化到抗炎症反应Th2型反应。一项未经检测的假设是伴随子宫内膜微生物感染的妇女可以发展成子宫内膜持续性炎症反应,从而易造成妇女妊娠囊受损、植入失败、自发性流产及早产。
早产仅仅代表了无数特有的、独立的病因的共同终点。早产的每一个通路都是以独特的上游启动因子为特点的。尽管如此,所有的通路都共享早产子宫收缩的下游效应因子。例如,不管是否与压力或是感染有关,胎儿HPA轴激活都发挥一定的作用。与之相似的是,不管是否与感染、子宫过度膨胀及PPROM有关,MMPs均起作用。最终,除去特有的起始环境,子宫收缩都受前列腺素的调节。这暗示着,预防早产的干预因素既可以是抑制假定通路的特异性上游启动因子,也可以是阻断下游效应因子。通过动物模型的建立可以对早产的机制进一步研究,评价实验治疗的效果。
附 早产动物模型的示例
1.两侧卵巢摘除诱发早产的模型 很早就有报告指出,来自胎盘和卵巢的激素对维持大鼠的妊娠非常重要。这个动物模型对妊娠18d的大鼠摘除两侧卵巢,12h内雌二醇(E2)1~2μg/个体的皮下注射诱导早产。两侧卵巢摘除后第二天血中的孕激素浓度骤减为(2.8± 0.2)ng/ml[非摘除大鼠为(95.1±4.4)ng/ml]。于两侧卵巢摘除后24~34h早产分娩开始。众所周知,孕激素除了免疫抑制作用外还有抑制子宫收缩及抑制宫颈管成熟的作用,因而,可以推测缺乏孕激素可诱发阵痛的发生。此外,此动物模型还报告子宫肌层的缩宫素受体浓度增加,血中缩宫素浓度上升。
2.米非司酮(RU-486)诱发早产模型 正常妊娠时胎儿发育伴随胎儿体重增加,胎动活跃,对宫颈内口周围的胎膜和子宫壁产生机械刺激,导致宫颈管细胞伸展。这种体内非感染性的炎症应答,诱导各种细胞因子产生。这些细胞因子在环氧化酶(cyclooxygenase,COX)-2的介导下产生强力的子宫收缩物质PGE2和PGF2α,同时促进白细胞游走,多种酶的活化使胎膜变得脆弱,从而促进宫颈管成熟。由于前面所述的孕激素抑制免疫应答与妊娠维持有关,考虑抗孕激素制药是强力的分娩诱发药。妊娠17d的大鼠给予米非司酮10mg/kg皮下注射,给药后23~30h早产分娩开始。与本模型对应,子宫收缩抑制药物盐酸利托君显示显著地宫缩抑制作用。
3.脂多糖(lipopolysaccharide,LPS)诱发早产模型 绒毛膜羊膜炎是居于首位的早产病因。本动物模型由感染细菌产生脂多糖,在小月份妊娠的腹腔内给药,诱发早产分娩,另外还有经阴道向子宫内注射脂多糖和感染菌诱发早产的报道。
4.雄烯二酮诱发早产模型 静脉给予妊娠后期(140d前后)的赤毛猿睾酮的前体物质(雄烯二酮)0.3mg/kg,可引起血中的雌二醇和催产素水平上升,诱发宫缩。而催产素拮抗药能抑制这种收缩。
[1]Challis JRG.Mechanism of parturition and preterm labor.Obstet and Gynecol Survey,2000,55:650-660
[2]Challis JRG,Matthews SG,Gibb W,et al.Endocrine and paracrine regulation of birth at term and preterm.Endocr Rev,2000,21:514-550
[3]Critchley H,Bennett P,Thornton S eds.Preterm Birth.London,UK:RCOG Press,2004:28-60
[4]Loudon JA,Sooranna SR,Bennett PR,et al.Mechanical stretch of human uterine smooth muscle cells increases IL-8mRNA expression and peptide synthesis.Mol Hum Reprod,2004,10:895-899
[5]Sooranna SR,Engineer N,Loudon JA,et al.The mitogen-activated protein kinase dependentexpression of prostaglandin H synthase-2and interleukin-8messenger ribonucleic acid by myometrial cells:The differential effect of stretch and interleukin-1b.J Clin Endocrinol Metab,2005,90:3517-3527
[6]Elovitz MA,Ascher-Landsberg J,Saunders T,et al.The mechanisms underlying the stimulatory effects of thrombin on myometrial smooth muscle.Am J Obstet Gynecol,2000,183:674-681
[7]Mackenzie AP,Schatz F,Krikun G,et al.Mechanisms of abruption-induced premature rupture of the fetal membranes:Thrombin enhanced decidual matrix metalloproteinase-3(stromelysin-1)expression.Am J Obstet Gynecol,2004,191:1996-2001
[8]Andrews WW,Hauth JC,Goldenberg RL.Infection and preterm birth.Am J Perinatol,2000,17:357-365
[9]Romero R,Erez O,Espinoza J.Intrauterine infection,preterm labor,and cytokines.J Soc Gynecol Investig,2005:12463-12465
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







