正常妊娠及分娩的进程与子宫的功能状态密切相关,在不同时期,子宫的收缩状态不同。根据子宫收缩状态的不同,可分为4个阶段来解释正常妊娠和分娩进程。图1-2对人类妊娠的各个阶段进行了总结。
(一)0期——静息期
胚胎植入后,随着妊娠进展,在妊娠期的大部分时间(约占95%)里,子宫是相对静止的,子宫的活动受到孕酮、前列环素(PGI2)、NO、松弛素和甲状旁腺激素相关肽等物质的抑制。对机械性和化学性刺激不敏感。
孕酮等物质虽然通过不同的机制起作用,但总体上来说,都是通过使细胞内环腺苷酸(cAMP)或环鸟苷酸(cGAM)水平上升,进而抑制细胞内钙的释放,使肌球蛋白轻链激酶(enzyme myosin light-chain kinase,MLCK)的活性降低。而钙离子和MLCK是子宫收缩的中心环节。钙可以激活钙调蛋白,进而引发MLCK的结构变化,肌球蛋白磷酸化,启动肌动蛋白和肌球蛋白之间的耦联,导致子宫收缩。通过抑制细胞内钙的释放,使MLCK的活性降低,这些物质使子宫处于抑制状态使宫缩抑制。
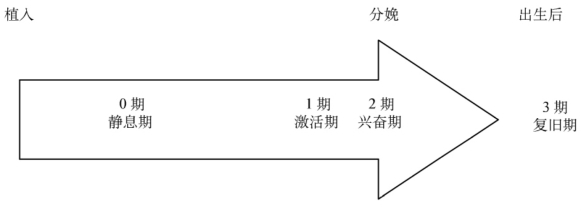
图1-2 妊娠及分娩的各个阶段
在静息期偶发宫缩的频率和幅度很低,缺乏协调性,在动物这种宫缩通常被称为挛缩,对孕妇来说则称为Braxton-Hicks收缩,也称为假宫缩。假宫缩缺乏协调性的主要原因是妊娠子宫肌细胞间缺乏间隙连接(gap junctions)。
(二)1期——激活期
本期为子宫肌层激活期,指从先兆临产至临产阶段。通常子宫肌层激活的信号来自于胎儿生长造成的子宫伸展,也可以来自胎儿成熟引起的下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴的激活,或是两者均有。子宫肌层的激活伴随着收缩相关蛋白(contraction-associated proteins,CAPs)如连接蛋白43(connexin43,CX-43,子宫肌细胞间隙连接的主要蛋白)、催产素受体等表达水平的不断提升和前列腺素增加。伴随着分娩的发动,子宫肌细胞间隙连接大量增多,间隙连接(与其相关蛋白一并被称为连接蛋白)允许肌细胞间的耦联,同时间隙连接还可促进钙离子向细胞内转移,加强子宫平滑肌的收缩。间隙连接的明显增加导致电耦联显著提升和整个子宫肌层大幅度的同步收缩,即出现规律宫缩。间隙连接明显增加、电协调性加强是有效宫缩所不可缺少的。
动物模型显示:子宫伸展使肌层中CAPs基因表达增多,但是这主要还是受内分泌环境的影响。孕酮阻止了子宫伸展诱发的CX-43表达水平的增长,然而,到妊娠足月伴随着功能性孕酮撤退,子宫伸展则与CX-43的表达水平显著增长有关。
当前的观点认为,一旦胎儿成熟,胎儿下丘脑和(或)胎盘的促肾上腺皮质素释放激素(CRH)分泌水平就提高,从而刺激胎儿垂体分泌促肾上腺皮质激素(ACTH)和胎儿肾上腺分泌皮质醇和雄激素。胎儿雄激素随后经胎盘芳香化酶作用形成雌激素。
(三)2期——兴奋期
本期为从分娩发动至胎儿娩出为止的共同通路,包括子宫收缩、宫颈成熟、蜕膜及胎膜的激活这一连串级联事件的发生。本期以胎儿HPA轴激活、功能性孕酮撤退、雌激素逐渐增多、前列腺素增加为特点。该级联可能从胎盘产生CRH开始,最终导致子宫肌层中功能性孕酮撤退,而孕酮撤退又使雌激素受体表达水平升高,使雌激素的活性提高。雌激素的活性提高导致许多雌激素性依赖CAPs生成,从而促进子宫收缩。
1.参与内分泌调控的有关激素
(1)CRH(促肾上腺皮质激素分泌激素)和胎盘钟:CRH在胎儿成熟和人类分娩过程中发挥核心作用。CRH是一种神经肽,可来源于下丘脑,也表达在人类胎盘和胎膜上,胎盘CRH是妊娠期CRH的主要来源,其不像下丘脑CRH呈现脉冲式分泌,而是与孕周有关。母体血浆CRH水平随妊娠进展成指数性增加,在妊娠晚期开始迅速增加。CRH mRNA表达在分娩时达到高峰。当胎盘娩出后,母体血浆CRH水平急剧下降,产后24h已基本恢复正常。CRH的增长轨迹与妊娠持续时间的长短相关。在即将早产的妇女中,早在孕16周时,母体血清中即有较高的CRH水平,而且CRH增长的水平要比足月分娩的妇女更快。这些发现使得研究者提出,胎盘CRH可能发挥着胎盘生物钟的作用,调节妊娠的持续时间。
糖皮质激素刺激胎盘CRH的合成,抑制下丘脑CRH的合成。胎盘CRH促进胎儿皮质醇和硫酸脱氢表雄酮(dehydroepiandrosterone sulfate,DHAS)的合成,这一正反馈环路逐步放大,驱使从胎儿HPA激活到分娩这一进程不断向前发展。胎盘CRH可通过提高前列腺素H2合成酶在绒毛膜和羊膜细胞的表达水平来提高前列腺素的生成,同时也形成另外一个正反馈环路,驱动分娩的进展。(www.daowen.com)
矛盾的是,在子宫静息期,CRH可能发挥子宫松弛的作用,而不是分娩的促进者。在妊娠的大部分时间里,子宫表达CRH1型受体,G蛋白(G-protein又称“GTP连接蛋白”,介导子宫松弛)将受体与腺苷酸环化酶和cAMP联系起来,当它们被激活时会使子宫松弛。然而,在妊娠晚期,CRH受体选择性结合的变异和Gsα亚单位表达水平下降,可能促进了子宫收缩特性的表达。
(2)功能性孕酮撤退:对于大多数的妊娠来说,子宫静息状态主要是由孕酮的作用来维持的。孕酮可维持子宫处于静息状态的机制包括:①可阻止CAPS基因的表达和子宫肌层间隙连接的形成;②抑制胎盘CRH分泌;③对抗雌激素活性;④上调促进子宫松弛的系统如NO的表达;⑤抑制细胞因子和前列腺素的表达。在多数哺乳动物的妊娠晚期,母体孕酮水平下降,雌激素水平上生。然而在人类,整个妊娠期直到胎盘娩出,孕酮和雌激素浓度持续升高。最近数据表明,在人类妇女和灵长类动物可能通过改变孕激素受体(progesterone receptor,PR)亚型的水平来促进功能性孕酮撤退的发生。在妇女,PR-B亚型的主要功能是作为孕酮-反应基因的激活剂,而PR-A亚型作为PR-B功能和其他核受体的抑制药。足月分娩的发动与子宫肌层PR-A的表达逐渐升高(相对于PR-B而言)有关。由于PR-A抑制孕酮的活动,相对于PR-B的PR-A表达水平的不断增长削减了子宫对孕酮的反应,结果导致功能性孕酮撤退,分娩得以继续进行。
(3)雌激素:与其他许多动物的胎盘不同,人类胎盘不能将孕酮转化为雌激素,因为人类的胎盘缺乏完成这种转化所必需的17-羟化酶。胎盘雌激素的生成主要依靠胎儿肾上腺胎儿带合成的前体雄激素;胎儿硫酸脱氢表雄酮(DHAS)在胎盘经芳香化酶作用所形成的雌酮和雌二醇大约占母体循环中的50%。胎盘CRH直接或间接(经胎儿垂体分泌的ACTH)刺激胎儿肾上腺胎儿带产生DHAS,因此胎盘CRH增加将促进雌激素生成。
雌激素依赖性CAPs包括CX-43、缩宫素受体、前列腺素受体、环氧合酶(COX)-2(导致前列腺素的合成)和MLCK(刺激子宫收缩和分娩)等,雌激素通过提高这些雌激素依赖性CAPs的表达参与分娩。
(4)前列腺素:前列腺素是由花生四烯酸在前列腺素H合成酶(prostaglandin H synthase,PGHS)作用下合成而来,在前列腺素脱氢酶(prostaglandin dehydrogenase,PGDH)的作用下代谢成非活化形式。皮质醇、CRH和雌激素刺激PGHS的活性,皮质酮和CRH也会抑制PGDH的表达。因此,伴随胎儿HPA轴(下丘脑-垂体-肾上腺)激活的胎儿甾体激素的合成增多导致前列腺素水平的增加。与之相似的是,促炎细胞因子诸如IL-1和TNF-α上调PGHS表达和下调PGDH表达,这样会导致在感染的情况下与早产相关前列腺素的合成。
很多证据支持前列腺素在促进子宫收缩方面起着核心作用。前列腺素通过特定的受体起作用,PGE2通过与前列腺素EP-1(E prostaglandin,EP)和EP-3受体结合,通过增加钙动员,使细胞液内钙浓度增高和减少细胞内cAMP抑制物的生成,诱发子宫收缩。前列腺素还可提高宫颈和蜕膜内基质金属蛋白酶(MMP)的合成,从而促进宫颈成熟和蜕膜及胎膜的激活。PGF2α与前列腺素F(F prostaglandin,FP)受体结合诱发子宫收缩。相反,在子宫下段的PGE2通过与EP-2与EP-4受体结合,刺激cAMP合成,诱发子宫松弛。
总之,由胎儿HPA轴激活引发的这些事件,致使胎儿和胎盘的激素生物合成不断增长,诱发进入分娩的共同通路,其中涉及宫颈成熟、子宫收缩、蜕膜及胎膜的激活。
2.内分泌激素与分娩相关过程的关系
(1)宫颈成熟:宫颈改变发生在分娩发动之前,渐进性的宫颈软化成熟通常持续好几周。宫颈成熟的特征性表现通常是胶原含量下降,胶原溶解性升高,溶胶原活性升高,导致宫颈细胞外基质结构改变。前列腺素、雌激素、孕酮和炎性细胞因子(如IL-8)影响细胞外基质的代谢。PGE2刺激溶胶原活性和缺少稳定性的蛋白质-氨基葡聚糖亚型的合成。
雌激素可刺激胶原体外降解,静脉内给予17β-雌二醇可诱发宫颈成熟。在体外,孕酮可以阻断雌二醇诱发的胶原溶解,下调宫颈IL-8的合成。除了这些激素以外,NO在某些环境下可发挥促宫颈成熟的作用,其聚集在炎症反应部位,在高浓度时行使炎症介质的作用。一氧化氮供体(如硝普钠)可诱使宫颈成熟,而一氧化氮抑制物(如亚硝基左旋精氨酸甲酯)阻碍宫颈成熟。
(2)子宫收缩性:子宫收缩来自于肌动蛋白和肌球蛋白的耦合,这需要通过MLCK进行肌球蛋白的磷酸化。各种子宫紧张肽包括缩宫素和前列腺素的活动造成了细胞液内钙水平的增加,在细胞内钙水平升高后,MLCK被钙-钙调蛋白所激活。缝隙连接和相关蛋白(例如连接蛋白)的形成利于细胞和细胞间的偶联,使子宫肌层在分娩时产生同步的大幅度的收缩。间隙连接和相关蛋白的形成在很大程度上依赖雌激素;在足月妊娠时雌激素的活化被功能性孕酮撤退所诱导。
(3)蜕膜和胎膜的激活:蜕膜和胎膜的激活指的是一组复杂的解剖学和生物化学变化,他们可以导致胎膜与子宫下段的蜕膜分离,最终造成自发性胎膜破裂。胎膜和蜕膜的激活的详细机制目前尚未阐明,但是细胞外基质降解酶如MMP-1、间质胶原酶、MMP-8(中性粒细胞胶原酶)、MMP-9(白明胶酶B)、中性粒细胞弹性蛋白酶和血纤溶酶均参与其中。这些酶降解细胞外基质蛋白(如胶原和纤维连结蛋白),因此使胎膜脆弱,最终导致破膜。一些MMPs如MMP-9,可能会诱导羊膜的细胞凋亡。
(四)3期——复旧期
3期从分娩的第三个阶段开始,包括胎盘剥离和子宫收缩。胎盘沿着蜕膜基底面剥离。子宫收缩对关闭宫腔内暴露的大静脉窦、预防产后出血起着重要的作用,主要受缩宫素的影响。
综上所述,人类分娩是由HPA轴激活和胎盘CRH表达不断增加所引起的一连串变化,造成功能性孕酮撤退和雌激素的激活,进而引起CAPs(包括催产素受体)、催产素、前列腺素的激活和表达。这一生物学级联最终导致包括宫颈成熟、子宫收缩、胎膜及蜕膜激活的共同通路,在第二阶段,母体催产素增加。自发的足月分娩和早产的基本区别是:足月分娩来自于共同通路的生理激活,而早产则源于病理过程激活分娩共同通路中一个或更多个因素。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





